Nous avons tous et toutes déjà été confrontés au cancer d’une manière ou d’une autre. Cependant, cette maladie reste encore mal comprise du grand public, et cet article va donc tenter d’en brosser un portrait simple. S’il fallait résumer en quelques mots, le cancer est une maladie qui provoque une prolifération incontrôlée des cellules de l’organisme, à partir d’une première cellule dont le génome s’est vu modifié pour lui conférer la capacité d’immortalité. Il s’agit donc avant tout d’une maladie génétique !
Avant d’expliquer plus en détail de quoi il retourne, il est nécessaire de faire quelques petits rappels. Et ne vous inquiétez pas, ça se fera tout en douceur ;-)
- Quand tout va bien dans le corps humain
- Le cancer : quand la cellule devient immortelle
- Les armes à notre disposition (oui, elle existent !)
- Et demain ?
Quand tout va bien dans le corps humain
Pour rappel, notre corps est composé d’une grande quantité de cellules, environ cent mille milliards (1014 !!), nous sommes dès lors des êtres pluricellulaires. Elles font entre 1 et 100 micromètres de long, ce qui signifie qu’il est nécessaire d’employer un microscope (mais pas forcément puissant en ce qui concerne les cellules végétales, qui sont en général assez grandes) pour les apercevoir.

Une cellule est comme un être vivant en miniature: elle mange, se reproduit et meurt. Dans l’intervalle, elle effectue des fonctions spécifiques, qui dépendent de son utilité et de son emplacement dans le corps : les cellules du foie permettent (entre autres) de stocker le sucre et de le libérer si besoin, les cellules nerveuses transmettent les influx électriques le long du corps, les cellules de la langue détectent les saveurs, les cellules des reins filtrent le sang, etc.

Mais quand on rentre à l’intérieur d’une cellule, on remarque que celle-ci est composée de plein de sous-éléments, parmi lesquels
- le noyau, qui contient l’ADN et sur lequel on aura l’occasion de revenir,
- les mitochondries, d’autres organites,
- le tout baignant dans un liquide, le cytoplasme, dans lequel on retrouve un grand nombre de protéines.
Une cellule est délimitée par des parois, qu’on appelle la membrane plasmique, et qui est constituée d’acide gras. Comme vous l’avez déjà remarqué, l’eau et l’huile (composée d’acide gras) ne se mélangent pas: comme l’extérieur de la cellule est principalement constitué d’eau, la membrane force cette eau à rester à l’extérieur. De la même manière, le cytoplasme, qui est majoritairement constitué d’eau (gélifiée), ne se déverse pas dans notre corps. En pratique il faudrait donc imaginer une "bulle" d’huile1.
Avant d’aller plus loin, il est nécessaire de définir le terme de protéine. Il s’agit une macromolécule (entendez par là une très grande molécule, on parle de plusieurs milliers d’atomes), composées de différentes briques de base, au nombre de 22 et toujours les mêmes au sein des êtres vivants, et qu’on appelle des acides aminés.
Il existe un grand nombre de protéines, aux utilités variées. Il existe par exemple des protéines "structurales", qui ont pour but de rendre les tissus (par exemple la peau) élastique et résistants. Vous en connaissez certaines de nom : le collagène (qu’on retrouve dans la peau), mais aussi la kératine (qui compose les cheveux). Dans un autre registre, on a aussi la tubuline, qui sert de "squelette" à la cellule et la maintient. Ensuite, certaines protéines servent de signaux (de messager), comme on le verra plus bas. Enfin, certaines sont capable d’accomplir une réaction chimique sur un réactif donné, toujours le même2 (un substrat) pour donner un produit donné, toujours le même, c’est alors ce qu’on appelle des enzymes. Il existe encore d’autres types de protéines, mais ce n’est pas important ici.
Dès lors, une enzyme est un chimiste miniature très (!) efficace et il existe un nombre incalculable d’enzymes différentes, avec une large gamme d’utilités. Ce sont elles qui, dans la cellule, font le travail, ce qui rend une cellule capable de faire énormément de choses. Ainsi, la vie d’une cellule est organisée en série de réactions enzymatiques successives qui sont appelées voies enzymatiques. Un exemple de telle voie, c’est la manière dont la cellule produit de l’énergie (autrement dit, "se nourrit") : elle part du sucre3 (et plus particulièrement de celui nommé glucose), qui provient de l’extérieur (quand vous vous nourrissez), et le transforme en énergie.
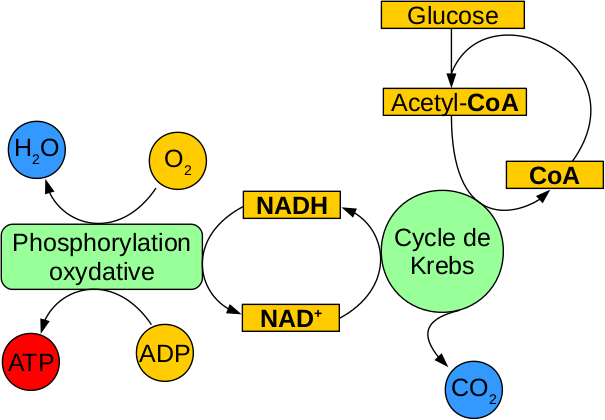
Le sucre provient bien entendu de l’extérieur de la cellule : il est transporté par le sang, et la cellule se sert quand elle en a besoin. Bien entendu, une molécule aussi grosse que le sucre ne passe pas la membrane plasmique d’elle-même : la membrane plasmique est tapissée de protéines permettant le transport de molécules de l’extérieur vers l’intérieur (et l’inverse). Ça veut dire aussi qu’il n’y a pas n’importe quoi qui passe à travers la paroi et que c’est très finement contrôlé : le transporteur est souvent sélectif et ne laisse passer des molécules qu’il "reconnait". Gardez bien ça en tête, ça sera important.
Mais la cellule communique également. Pour cela, il faut un système de détection d’un signal donné, un système de transduction du signal (pour le propager) et enfin un système effecteur qui va répondre au signal.
Pour la détection, la membrane plasmique est également tapissée de récepteurs, qui sont encore un autre type de protéine. Ces récepteurs fonctionnent un peu sur le même principe que les transporteurs, car ils ne réagissent également qu’à certaines molécules qu’ils reconnaissent. Quand un récepteur reconnaît une molécule, elle déclenche, une fois encore, une cascade de réactions enzymatiques, qu’on nomme voie de transduction du signal.
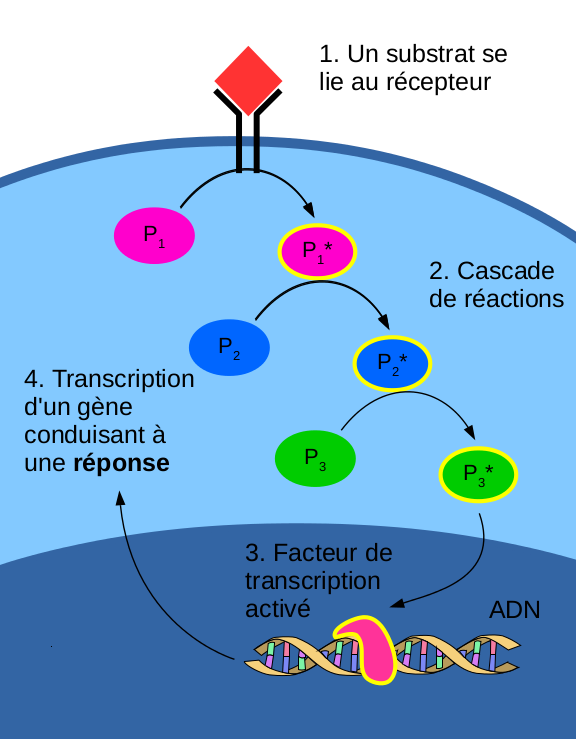
Les molécules qui servent de signaux font généralement partie de la classe des neurotransmetteurs ou des hormones : vous connaissez par exemple l'adrénaline (aussi appelée épinéphrine, c’est l’hormone du stress), l’œstrogène et la progestérone (qui sont deux hormones du cycle féminin et sont présentes sous des formes relativement semblables dans la pilule contraceptive) ou encore l'histamine (entre autres impliqué dans la réponse aux allergies, qu’on neutralise à l’aide des médicaments antihistaminiques). Comme dit plus haut, certaines protéines peuvent servir de signal, c’est par exemple le cas de l’insuline, hormone impliquée dans la régulation du taux de sucre dans le sang. Ces molécules ne se lient pas forcément à des récepteurs, certaines sont en effet capable de passer la membrane plasmique, mais le principe reste le même.
Une voie de transduction du signal finit souvent (mais pas toujours) par interagir avec l’ADN. Pourquoi ? Pour ceux qui aurait dormi en biologie, bref rappel: l’ADN est une très longue molécule (par ailleurs chirale), dont la fonction est d’être le support de l’information génétique. Autrement dit, l’ADN contient la "recette" de toutes les protéines de l’être humain, sous forme de gènes. Ces gènes, véritables modes d’emploi, décrivent la séquence d’acide aminé qui compose la protéine. Ces gènes sont "activés" (la cellule produit les protéines) par des facteurs de transcription qui sont des protéines (encore!) qui se placent en amont du gène pour indiquer que la transcription doit être faite. Une voie de transduction du signal va modifier l’expression des gènes via ses facteurs de transcription : elle peut les activer (de nouvelles protéines seront synthétisées, on dit alors que le gène est exprimé) ou les désactiver (certaines protéines ne seront alors plus produites). Ainsi, la cellule "répond" aux différents signaux extérieurs en modifiant son comportement.
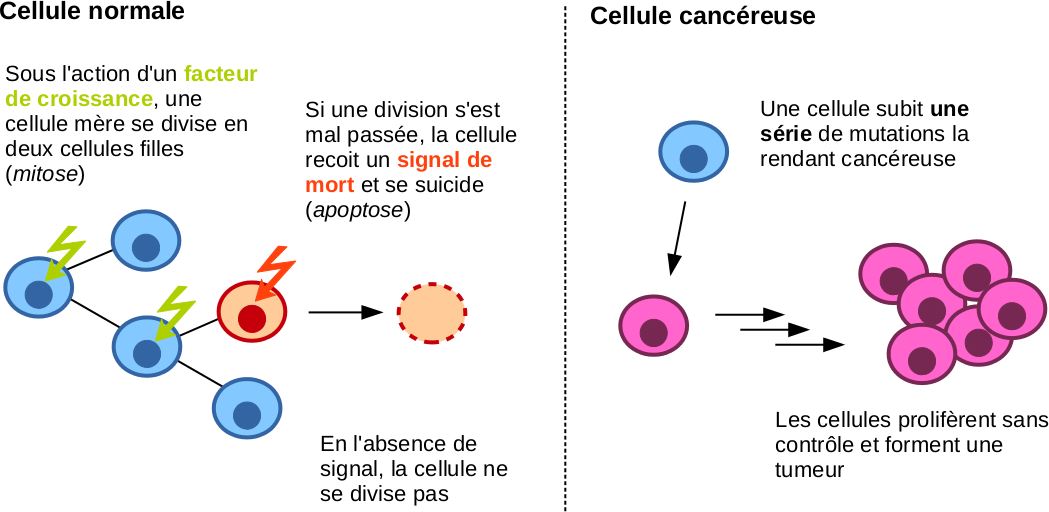
Un certain nombre de fonctions d’une cellule sont régulées par des signaux extérieurs. On peut par exemple citer les facteurs de croissance, qui induisent la division cellulaire (pour rappel, les cellules se reproduisent en se divisant, et on retrouve donc ces facteurs de croissance dans le processus de cicatrisation). À l’inverse, il existe des signaux pour empêcher la division cellulaire (c’est un des effets de l’adrénaline, par exemple: la division cellulaire est un processus coûteux en énergie, en cas d’urgence, mieux vaut l’employer à autre chose). Il existe par ailleurs des "signaux de mort", qui disent tout simplement à la cellule de se suicider, le suicide d’une cellule est un événement appelé l'apoptose.
À noter que l’apoptose n’est pas la seule cause de mort cellulaire. Ainsi, on distingue l’apoptose, qui est un processus "normal" (ayant entre autre pour but de recycler les cellules) de la nécrose qui est un processus incontrôlé. Une autre différence est que le processus d’apoptose est "propre" dans le sens ou la cellule se désagrège en un certain nombre de "corps apoptotiques" comme autant de sacs poubelles que l’organisme pourra ensuite traiter, alors que la nécrose produit en général une explosion de la cellule sans autre forme de procès4. Pour être tout à fait complet, on peut aussi préciser que l’apoptose n’est pas le seul moyen qu’a la cellule de se suicider, même si c’est le plus employé.
La durée de vie d’une cellule varie avec sa fonction: ainsi, une cellule de la peau (on parle de cellule épithéliale) vit quelques semaines, tandis que les neurones ont une durée de vie qui est à peu près celle de l’humain qui les utilise. Durant ce temps, des mécanismes de contrôles s’assurent que la cellule ne fait pas n’importe quoi. Par exemple, l’ADN contient l’information en double: un brin et son négatif. Il existe en permanence des protéines qui parcourent l’ADN et le répare dans le cas ou un brin et son négatif ne correspondent pas. De plus, on a constaté que l’ADN semblait contenir la même information plusieurs fois, et également beaucoup de parties "inutiles"5, qui sont retirées durant la traduction de l’ADN en protéine (ce qu’on appelle les introns): si une partie est endommagée, l’effet est minimisé. Et si la cellule est trop endommagée (qu’elle ne peut plus assurer ses fonctions), le verdict est sans appel : la mort, afin de ne pas faire de dégât. Ce mécanisme peut être induit par le système immunitaire, qui se lie à la cellule par des récepteurs sobrement nommés "récepteurs de mort". La cellule peut également déclencher sa propre mort, si elle constate que quelque chose ne va pas (par exemple trop de dommage à l’ADN).
- Un peu comme les bulles de savon, où il y a de l’air à l’extérieur et à l’intérieur.↩
- Ou en tout cas de structures chimiques assez semblables !↩
- Le corps est également capable de produire de l’énergie à partir d’acides gras.↩
- Si vraiment vous y tenez, cet article de Wikipédia détaille les causes et conséquences de la nécrose et sa différence avec l’apoptose.↩
- En fait, "inutile" n’est pas tout à fait vrai. D’une part, il y a des segments d’ADN qui sont des promoteurs de traduction, autrement dit des endroits pour indiquer où commence la traduction. D’autre part, certains biologistes pensent que cet ADN sert tout de même, bien qu’on en connaisse pas encore la fonction.↩
Le cancer : quand la cellule devient immortelle
Tous ces concepts en poche, revenons-en au cancer. Souvenez-vous, on a dit dans l’introduction que le cancer était une cellule devenue immortelle: il faut donc qu’elle ne réagisse plus aux signaux de mort induits par elle-même ou l’extérieur. Et si l’immortalité est un pouvoir bien sympa dans les jeux vidéos, c’est le début des ennuis pour le corps puisque le corps n’est plus capable de tuer cette cellule. Car non, le système immunitaire n’est pas capable de supprimer une cellule de lui-même : il faut que la cellule "accepte" son auto-destruction, entendez qu’elle doit réagir au signal de mort envoyé par le système imunitaire1.
Comment un cancer ce développe-t-il ?
Pour qu’une cellule devienne cancéreuse, la modification (ou mutation) doit survenir au niveau de l’ADN : l’expression des gènes doit être modifiée. Ainsi, certains gènes dits oncogènes sont normalement inexprimés par la cellule, peuvent l’être. À l’inverse, certains gènes sont dits suppresseurs de tumeurs et normalement exprimés par la cellule, mais la modification de l’ADN peut avoir l’effet inverse. Dans cette catégorie rentrent par exemple les gènes codant pour les protéines impliquées dans la réparation de l’ADN et celles induisant l'apoptose en cas d’erreur.
Les causes sont multiples : on sépare ainsi celles qui sont exogènes, issues de toutes les expositions environnementales que nous pouvons subir telles que les radiations, les Uvs, le tabac et autres2 et les causes endogènes, causées par notre propre métabolisme (entre autres les peroxydes, que vous connaissez probablement sans le savoir à cause du peroxyde d’hydrogène, couramment appelé eau oxygénée et oxydant puissant). Relativisons tout de suite : de telles attaques arrivent en permanence, et le système de réparation de l’ADN est très efficace (bien qu’il semblerait que son efficacité se réduise avec l’âge, ce qui expliquerait le nombre de cancers chez les personnes âgées). Par ailleurs, il faut que la mutation intervienne au niveau des gènes oncogènes ou suppresseurs de tumeur, et comme dit précédemment, l’ADN est une très longue molécule, donc cette probabilité est faible3.
Malheureusement, probabilité faible ne veut pas dire probabilité nulle. Et comme une série de dominos, l’immortalité n’est que le début d’une réaction en chaîne: puisque la reproduction est la copie à l’identique de la cellule-mère, les cellules filles seront aussi immortelles. Et puisque immortelles et incapables d’apoptose, elles sont sensibles à de nouvelles mutations sans que rien ne les empêche de proliférer. Dans la plupart des cas vont alors apparaître des tumeurs cancéreuses, qui sont des amoncellements de cellules, cancéreuses et incapables de mourir.
Au fur et à mesure des reproductions et des mutations, les cellules cancéreuses finissent par acquérir d’autres caractéristiques qu’on retrouve dans un grand nombre de cancers. En 2006, deux médecins (R. Weinberg et D. Hanahan) ont ainsi proposé que l’apparition d’un cancer était due a une combinaison de d’au moins 6 propriétés (4 ont été rajoutées par la suite) :
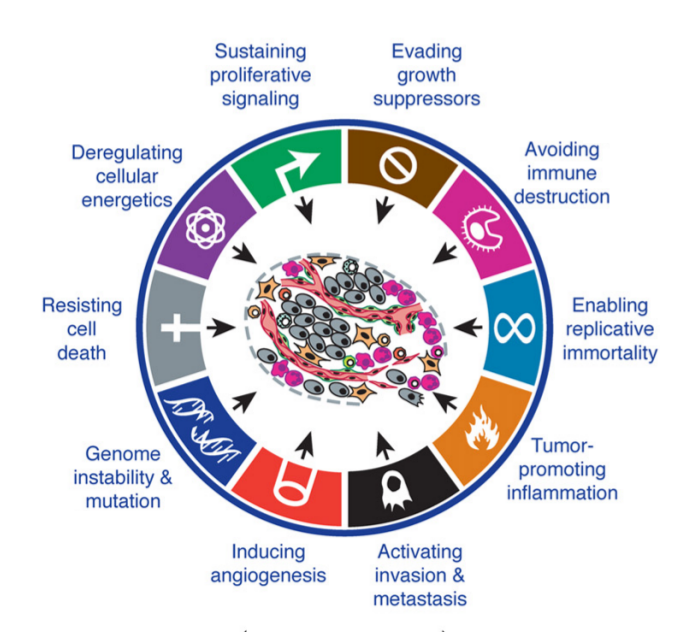
On peut résumer cette infographie comme suit:
- La résistance à la mort cellulaire, qui a déjà été discutée. Ceci étant dit, ça ne signifie pas qu’il s’agit de la première mutation que subit une cellule quand elle devient cancéreuse (elle pourrait en subir d’autres auparavant), mais c’est le moment ou elle devient incontrôlable. On peut également ranger dans cette catégorie la suppression de la dépendance aux facteurs de croissance : la plupart des cellules ont besoin qu’on leur confirme leur utilité, et donc doit recevoir en permanence des facteurs de croissance (l’absence de ceux-ci pouvant conduire à la mort de la cellule). Les cellules cancéreuses s’affranchissent de cette dépendance.
- Pour que ça fonctionne, ces capacités doivent bien entendu être transmises aux cellules filles, donc les mutations doivent avoir eu lieu au niveau de l’ADN. En effet, si il y a eu une erreur lors de la transcription du gène en protéine et qu’on a une cellule aux protéines dysfonctionnelles, il n’est pas dit que cette erreur sera transmise aux cellules filles.
- La plupart du temps, les mécanismes de réparations de l’ADN ne fonctionnent plus ou induisent plus d’erreurs qu’ils n’en corrigent. Ce facteur entretient les mutations et a pour effet pervers d’en générer de nouvelles.
- Les cellules ne se reproduisent normalement qu’en présence du signal adéquat. Les cellules cancéreuses n’ont plus besoin de ce signal pour proliférer. Par ailleurs, il existe une limite au-delà de laquelle une cellule ne peut plus se reproduire (environ 50 fois, voir à ce sujet le magnifique tuto de Mewtow), mais les cellules cancéreuses sont capables de se reproduire à l’infini.
- Les cellules cancéreuses vont chercher à se maintenir en vie en amenant à elles ce dont elles ont besoin pour se "nourrir", principalement du sucre et de l’oxygène. Pour cela, elles vont induire l'angiogenèse, c’est-à-dire la croissance des vaisseaux sanguins. À noter qu’une cellule cancéreuse résiste beaucoup mieux à l’hypoxie, c’est-à-dire l’absence d’oxygène. En effet, dans une masse tumorale, les cellules au centre de celles-ci ne sont pas approvisionnées en oxygène, ce qui devrait normalement tuer la cellule. Ce n’est plus le cas pour les cellules cancéreuses, et source d’un grand nombre de problèmes dans les traitements.
- Et finalement, si tout ça ne suffisait pas, les cellules finissent par acquérir un pouvoir invasif : normalement, une cellule ne se déplace pas4, mais les cellules cancéreuses peuvent arriver dans les vaisseaux sanguins et être transportées pour former des tumeurs secondaires, ou métastases.
Une cellule cancéreuse n’est pas obligée d’acquérir toutes ces caractéristiques, et l’ordre n’a pas d’importance, mais on a constaté que bon nombre de caractéristiques se retrouvaient sous une forme ou une autre dans une lignée cancéreuse. Un cancer est donc une suite de mutations : une seule mutation n’aura que peu d’importance et sera en général repérée et éliminée par l’organisme. Là ou ça devient dangereux, c’est quand plusieurs mutations entrent en jeu, et c’est ce qui explique souvent que les cancers sont repérés tard.
Un cancer peut se déclencher dans n’importe quelle zone (et cellule) du corps, même si certains cas sont plus fréquents que d’autres. Ainsi, le cancer le plus fréquent chez l’homme est celui de la prostate, contre celui du sein chez la femme (plus d’un tiers des cancers chez la femme). Viennent ensuite, tous sexe confondus, les cancers du côlon-rectum et celui du poumon5. Ces cancers représentent la moitié des nouveaux cas chaque année. Plusieurs rapports démontrent que, parmi ceux-ci, c’est le cancer du poumon qui est le plus mortel. Finalement, plus de 60% des hommes et femmes ont plus de 60 ans lors du diagnostic, ce qui indique que les cancers sont plus présents chez les personnes âgées. Cependant, il existe des cancers qui frappent très jeunes, parmi lesquels la leucémie (cancer des cellules de la moelle osseuse, qui produisent les cellules sanguines).
Quelles sont les conséquences ?
Si on a bien parlé des causes et des effets, on a pas encore répondu à une question très importante : en quoi le cancer nous affecte-t-il ? Pourquoi une prolifération de cellules immortelles n’est pas une bonne chose du tout ?
Déjà parce que puisque les cellules cancéreuses échappent à toute régulation, leur besoins en énergies sont incontrôlés. La mitose d’une cellule (donc la division cellulaire d’une cellule mère en deux cellules filles) n’est pas un processus anodin en terme d’énergie, et c’est une des raisons pour laquelle c’est l’un des premiers à être désactivé en cas de besoin (en cas de fort stress, par exemple). Les cellules cancéreuses drainent donc les nutriments à elles (par exemple grâce à l’angiogenèse), au dépens d’autres partie du corps. Un corps plus fatigué (parce que les nutriments sont détourné) aura du mal à se défendre contre d’autres infections.
Ensuite parce que l’agrandissement de la tumeur peut à terme générer le dysfonctionnement de l’organe qui l’as vu naître, ce qui n’est jamais une bonne idée, ou bloquer des vaisseaux sanguins, les voies respiratoires, les conduits digestifs, l’apport d’oxygène au sang dans les poumons, …6
Finalement parce qu’il arrive souvent un moment ou le cancer génère des métastases, c’est à dire que certaines cellules de la masse tumorale aillent se fixer ailleurs dans le corps par l’intermédiaire des vaisseaux sanguins, ce qui "permet" au cancer d’aller faire des dégâts ailleurs dans le corps, avec comme conséquence ultime la mort de l’hôte. Et comme si ça ne suffisait pas, il est plus difficile de traiter plusieurs tumeurs qu’une seule.
- parmi lesquels les globules blancs, qui sont en fait une grande famille de différentes cellules. Ici, c’est plus particulièrement les lymphocytes NK qui entrent en jeu.↩
- Citons également les intercalant de l’ADN (un certain nombre de molécules polyaromatiques), les particules fines, qui réussissent à passer les parois de la cellule, ou encore les cancers induits par certains virus comme le papillomavirus. Il existe également, et malheureusement, des cancers qui sont héréditaires.↩
- À noter qu’il existe des "mutations silencieuses" qui proviennent du fait que plusieurs séquences de nucléotides codent pour le même acide aminé.↩
- Les exceptions étant les cellules qui se déplacent dans les vaisseaux sanguins, c’est-à-dire les globules rouges et blanc. Par ailleurs, les spermatozoïdes se déplacent. Et puisqu’on en est à parler de sexe, il me faut mentionner que les cellules sont capable de se déplacer au cours du développement embryonnaire.↩
- Les rapports de l’un par rapport à l’autre étant inversé dans les statistiques belges pour la femme (source).↩
- Voir à ce sujet cet article (en) de l’association de lutte contre le cancer anglaise.↩
Les armes à notre disposition (oui, elle existent !)
Avant de parler de traitement, il est bien important de se rappeler quelque chose: chaque cancer est unique : bien que présentant des caractéristiques semblables, les mutations peuvent survenir n’importe où. L’idée d’un traitement unique contre le cancer est donc probablement illusoire, et c’est ce qui explique le grand nombre de médicaments sur le marché et en tests cliniques. Comme précisé auparavant, il n’existe actuellement pas de moyen de "reprogrammer" une cellule cancéreuse1, et c’est pourquoi il est nécessaire de les éliminer au maximum.
Plus un cancer est détecté tôt, plus il a de chance d’être soigné : moins le cancer a eu de temps pour se développer, moins il y aura de cellules cancéreuses à détruire. Par ailleurs, il faut à tout prix éviter la formation de métastases (voir plus haut), qui obligent en général à des traitements plus lourds (car non locaux). Le problème est que les cancers sont assez complexes à détecter (quand ils sont visibles, il est souvent déjà trop tard), et un grand nombre d’études cherchent aujourd’hui à détecter des symptômes qui surviennent avant la progression du cancer.
Le dépistage
Il faut tout d’abord rappeler que chaque cancer se détecte de manière différente.
Par exemple, une méthode simple est la détection d’excroissances, qui est utilisée dans le cas du cancer du sein, de la prostate (toucher rectal) ou des cancers colorectaux (par une coloscopie). Les tumeurs, quand elles sont relativement importantes, génèrent des excroissances (cancer colorectaux ou de la prostate) ou des anomalies (cancer du sein, détecté par palpation par un médecin entraîné). De la même manière, les rayons X peuvent être employés dans certains cas, notamment pour le cancer du sein via une mammographie (les tissus cancéreux étant plus denses que ceux du sein, il se voient "bien"). C’est aussi un des moyen de diagnostic des cancers du poumon.
Une autre méthode est de se baser sur le fait que, comme décrit plus haut, les cellules cancéreuses sont fortes consommatrices de nutriment. L’idée est alors de faire absorber au patient des nutriments (souvent des sucres) dont certains atomes sont radioactifs, attendre leur diffusion dans l’organisme, puis de détecter les zones à forte réponse via un PET scan, qui détecte les particules émises par la désintégration des noyaux radioactifs.

Un autre cancer "connu" est le cancer du col de l’utérus2. La méthode de détection est le "frottis", qui consiste à prélever des cellules des parois du col de l’utérus et à les observer au microscope afin de détecter les anomalies (cette observation ne pouvant être faite que par des personnes spécialisées).
Il est également possible de détecter certains cancers par prise de sang : on peut par exemple détecter le cancer de la prostate par détection d’un taux élevé d'antigène prostatique spécifique, une protéine qui sert à liquéfier le sperme. D’autres traces de cancers sont détectables dans le sang, entre autre le cancer du pancréas (en). Certains aimeraient également trouver un moyen de détecter ce dernier à l’aide d’urine.
Bien entendu, il y a des risques de faux positifs. La confirmation se fait généralement par biopsie, c’est à dire le prélèvement d’un tout petit peu de ce qui semble à priori être la tumeur cancéreuse. Cet échantillon peut alors être analysé en profondeur par toute une batterie de tests qui vérifie par exemple la présence et l’action de certains gènes, ou par des tests colorimétriques de certaines molécules. Cette méthode est très invasive puisqu’elle requière d’accéder à la tumeur, là ou les autres méthodes sont plus indirectes.
À noter qu’il existe des personnes à risque : certains cancers (pas tous) sont par exemple transmissibles à l’enfant. Certaines personnes naissent donc avec certains gènes pro-cancers qui sont actifs, ce qui augmente les chances d’effectivement développer un cancer (n’oubliez pas qu’un cancer provient d’une accumulation de facteurs et que naître avec ces gènes ne fait pas de vous une personne cancéreuse d’office). Selon le type de cancer, il est donc parfois nécessaire de dépister également les membres de la familles, afin d’écarter le risque. Et n’oubliez jamais que plus un cancer est détecté tôt, plus il est "facile" de le soigner.
La lutte contre le cancer
Petite digression : comment fait-on des médicaments ?
Rappelez-vous qu’il a été dit que les protéines étaient très fortement spécifiques à leurs substrats. Cela provient du fait que la protéine "reconnait" la molécule par différents mécanismes de type moléculaires3. Autrement dit, on peut employer l’analogie d’une clé et d’une serrure: la protéine ne fonctionne que si on lui donne la bonne "clé". Sauf que cette reconnaissance n’est pas parfaite, et qu’on peut parfois employer des molécules dont la structure (ou des éléments de celle-ci) est semblable, mais qui interagissent mieux avec la protéine.
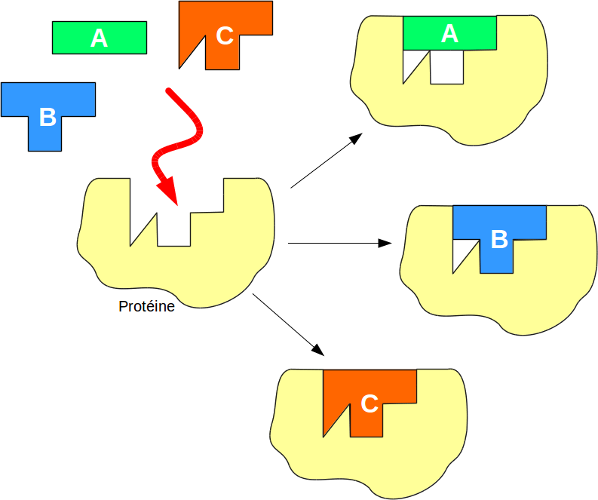
La cause de cette meilleure reconnaissance est multiple. Un des facteurs est que le phénomène de rencontre d’un substrat et d’une protéine est chaotique : le substrat se balade dans le milieu et la protéine aussi, et il existe une probabilité que les deux se rencontrent. À ce moment, si la reconnaissance est bonne, la "capture" du substrat par la protéine sera d’autant plus facile (parce que rien n’indique que l’un sera bien positionné par rapport à l’autre).
Le rôle d’un chimiste qui cherche à créer un médicament est, dans le meilleur des cas, d’avoir une idée de ce que contient le site actif de la protéine (l’endroit où se lie le substrat) afin de générer une structure qui s’y adapte mieux. Il peut également fonctionner par essais-erreurs afin d’obtenir la meilleure structure possible (souvent, on n’a pas la structure de la protéine ciblée, ou pire, on ne sait pas quelle est la protéine ciblée). Il est également soumis à quelques impératifs: entre autres, le composé ne doit pas être toxique (ou avoir une toxicité faible relativement à la dose utile à la guérison) pour l’être humain4, et doit être administrable le plus facilement possible (il est plus facile de prendre une pilule que de devoir se déplacer à l’hôpital pour une intraveineuse).
Le but d’un médicament est donc défini par la substance active qu’il contient (une partie très importante du médicament étant de l'excipient, c’est-à-dire toute autre substance visant à donner au médicament une forme ou un gout sans en altérer l’efficacité). Cette substance active a donc un rôle auprès de la protéine qu’elle cible, et peut avoir pour but de la bloquer (la protéine devient alors inactive) ou de l’activer, si on cible un récepteur transmembranaire. Tout le problème, si on vise une protéine, c’est de passer la membrane plasmique, ce qui nécessite également certaines adaptations de la structure.
Lutte proprement dite
Le but étant de retirer les cellules cancéreuses, une des solutions est la chirurgie afin d’enlever la tumeur. Comme il faut être sûr de bien enlever toute les cellules cancéreuses, c’est également une solution assez radicale, puisqu’on enlève généralement plus que nécessaire, par mesure de prévention. C’est une solution qui est applicable quand le nombre de métastases est peu élevé. Comme la biopsie, c’est également une méthode qui n’est pas sans risque car très invasive.
Ceci dit, on tend aujourd’hui vers d’autres solutions moins "invasives", telles que les radiothérapies ou les traitements au laser. Le principe sous-jacent est assez simple : on choisi un rayon d’une fréquence telle que ce rayon seul ne fait que très peux de dégâts, car l’énergie qu’il "transporte" est faible. On en concentre plusieurs sur un point : l’accumulation des rayons (et de l’énergie) détruits alors les cellules localement et de manière très précise. Ces traitements sont parfois employés en compléments à la chirurgie.
Ces deux méthodes sont assez localisées, donc elles ne sont applicable uniquement avant que le cancer ait fait des métastases, ou quand le nombre de celles-ci est faible : on ne peut pas multiplier les opérations chirurgicales ou de rayons sur différentes zones du corps sans causer de dégâts. À contrario, les méthodes suivantes agissent de manière "globales" et tirent parti du fait que les cellules cancéreuses sont plus demandeuse en nutriment que les autres, donc potentiellement plus la cible de médicaments (même si on tente également de cibler le médicament pour avoir une plus forte affinité pour les cellules cancéreuses, par différents moyens).
On peut d’une part utiliser la photochimiothérapie: on inonde la tumeur de molécules dont la réaction à la lumière produit des intermédiaires hautement toxiques pour la cellule cancéreuse5. De la même manière, il est possible d’utiliser des particules qui se mettent à chauffer une fois exposées à une certaine longueur d’onde ou sous l’action d’ultrasons. Une théorie récente vise également à s’aider d’anticorps monoclonaux (en), c’est à dire injecter au malade des anti-corps qui reconnaîtraient spécifiquement des cellules cancéreuses et induiraient une réponse immunitaire. Cette approche est freinée du fait que les cancers présentent de grandes différences et qu’il est difficile de trouver "le" ou "les" anticorps qui reconnaîtraient les cancers. Ceci étant dit, ces anticorps peuvent ensuite être modifiés pour injecter à la cellule cancéreuse une toxine ou autres (plus d’informations sur ce schéma (en)).
Il reste finalement les chimiothérapies. Comme dit précédemment, chaque cancer est unique, bien qu’ils partagent des caractéristiques communes, ce qui fait que ses thérapies sont en général des cocktails de plusieurs médicaments dont les actions sont très précises. Le mélange est adapté en fonction des données dont dispose le médecin (éventuellement issues d’une biopsie) et de la réponse du patient. Le but intrinsèque de ces médicaments étant de tuer la cellule cancéreuse tout en épargnant les cellules saines. Pour ça, une idée très importante (et qui a démontré son succès) est de tenter de réactiver le mécanisme d’apoptose et de forcer malgré tout la cellule à ce suicider. Malheureusement, il n’existe pas qu’une seule voie enzymatique conduisant à celle-ci, et on est loin d’en connaitre toutes les ramifications6, et il faut à tout prix éviter les effets secondaires7 (même si on préfère parfois des médicaments avec certains effets secondaires, en connaissance de cause, que pas de remède du tout).
- On peut effectuer certaines mutations dirigées en laboratoire dans des conditions particulières, malheureusement inapplicables dans ce cas.↩
- Cancer particulièrement "intéressant", parce qu’il s’agit d’un cancer qui peut être transmis par l’infection d’un virus le papillomavirus, qui est un virus à ADN (au même titre que l’Herpès). En résumé, il s’agit d’un virus qui remplace un petit morceau d’ADN par le sien, afin que ce soient les protéines de traduction de l’hôte qui le réplique à sa place. Par manque de chance, dans l’ADN inséré se trouve des gènes promoteurs de tumeurs, ce qui augmente la probabilité que les cellules infectées deviennent cancérigènes à posteriori (l’insertion étant bien entendu permanente et transmise aux cellules filles). Il n’existe donc aucun traitement autre que la destruction des cellules infectées.↩
- Typiquement des interactions "faibles" entre le substrat et la protéines: liaisons ioniques, interactions de type van der Walls, ponts hydrogènes, --stacking, …↩
- Ce pourquoi les protocoles de tests dans le domaine sont très précis. Ainsi, une molécule doit passer par différentes étapes : tests sur cellule, tests sur les animaux, tests cliniques sur sujets sains, puis tests cliniques sur sujets malades.↩
- La plupart du temps des radicaux. Les réactions radicalaire étant très difficiles à contrôler, les dégâts pour les cellules cancéreuses sont très importants.↩
- Paradoxalement, il existe encore beaucoup de protéines qui ont été découvertes et dont on ne connait pas la fonction, au travers de méthodes de détections systématiques. C’est petit a petit qu’on constate leur sur-expression ou disparition dans certaines situations et qu’on construit des voies enzymatiques.↩
- Tout est relatif: on préférera un médicament qui, malgré ses effets secondaires désagréables, augmente significativement le taux de survie.↩
Et demain ?
Le développement de la recherche sur le cancer a aujourd’hui permis d’améliorer les diagnostics et l’efficacité des traitements. Beaucoup de chercheurs à travers le monde découvrent aujourd’hui des substances et des traitements qui améliorent l’espérance de vie des patients. Les diagnostics gagnent également en efficacité, ce qui permet à des cancers d’être découverts plus tôt et traité de manière plus efficaces. Aujourd’hui, il est possible de guérir du cancer !
Par ailleurs, différentes études tendent à démontrer l’effet de différents composés dans les apparitions de cancers : par exemple, plusieurs études s’accordent pour souligner le lien entre tabac et cancer. On peut également citer, par exemple, une étude de 2002, qui a mis en évidence le lien probable entre HTS (l’hormonothérapie substitutive1) et cancer du sein et qui a permit de voir une réduction des cas ses dernières années, mises en évidence par plusieurs sources.
Le nombre de cancer augmente chaque année, principalement à cause du vieillissement de la population et de l’augmentation du nombre d’humain sur terre, et on estime qu’environ une personne sur quatre (entre 20 et 40%, selon les régions) sera confrontée au cancer dans sa vie, bien que ces statistiques soient difficiles à interpréter vu l’amélioration des techniques de diagnostic permettant de découvrir de plus en plus de cas (et de plus en plus tôt). On estime cependant que le taux de survie a été fortement amélioré en une cinquantaine d’années grâce à tout ces progrès et que bon nombres de patients sont aujourd’hui assurés de survivre à la maladie (on parle, en fonction des études et des régions, d’un taux de survie de plus de 50% au delà de 5 ans après le diagnostic, et ce taux est encore meilleurs concernant certains types de cancers). Et même s’il s’agit de statistiques, il ne faut pas oublier que derrière il s’agit d’êtres humains: les scientifiques ne sont pas contents parce qu’ils ont réussi à augmenter de 10% le taux de survie à 5 ans. Le but, c’est de sauver, autant que faire se peut, tout le monde !
Tout ça ne doit pas faire perdre de vue que la recherche dans le domaine du cancer reste très active, et ne demande qu’à l’être encore plus: beaucoup de pistes existent et sont actuellement explorées, et certaines demandent à l’être. Il faut également saluer le travail des médecins qui aident les patients au quotidien et offrent dépistages, facilités de traitement, soutient et conseils.
Et s’il fallait finir sur un conseil, c’est celui-ci : « participez au campagne de dépistages si elles vous concernent ». Vraiment.
- L’hormonothérapie substitutive est employée pour réduire les symptômes de la ménopause complétant l’apport en hormones du cycle féminin en substitution de celle dont l’expression disparaît petit à petit avec le processus de ménopause (œstrogène et progestérone). Plusieurs études mettent en évidence le lien entre ces hormones et différents cancers, dont celui du sein (source).↩
Cet article est dédié à toutes les personnes qui luttent contre le cancer : patients, médecins et chercheurs.
Je m’excuse pour toutes les approximations qui sont faites, parfois au nom de la simplicité. Le domaine du cancer est très vaste et très complexe, et certains résultats sont parfois contradictoires, sans compter le fait que la recherche est en constante évolution.
Merci à Blackline pour l’icône de l’article et l’illustration. Merci aussi à Goeland Croquant pour ces très nombreuses remarques durant la bêta de cet article, ainsi qu’à artragis pour la validation.
Sources et liens :
- Les pages Wikipédia de la cellule, la membrane plasmique et des récepteurs membranaires ;
- Les pages Wikipédia du cancer et de l’apoptose ;
- Les pages Wikipédia sur les hormones et neurotransmeteurs ;
- Les pages Wikipédia sur les facteurs de croissance (en) et la transduction du signal (en) ;
- Pistes de lien entre vieillissement et cancer, issus de La société Francaise de sénologie et de pathologie mammaire (SFSPM) ;
- The hallmarks of cancer (en) et Hallmarks of cancer: the next generation (en), les deux articles de D. Hanahan et R. Weinberg sur les caractéristiques du cancer, disponibles en libre accès ;
- Traitements du cancer, par la fondation contre le cancer (Belgique) ;
- Les rapports français de 2014 (PDF disponible en bas de page), belges sur le taux de survie et sur les cancers chez les enfants, américain sous formes de Fact and Figures, de 2015 (en), canadien de 2015 (PDFs sur la page) et suisse couvrant la période de 1983 à 2007, issus des différentes associations de lutte contre le cancer de chacun de ces pays ou régions.
Pour aller plus loin :
- « Couper court à l’immortalité des cellules cancéreuses », via ULG réflexion, un article en lien avec la problématique déjà soulevée par le tutoriel de Mewtow sur le vieillissement cellulaire ;
- « Traitements anti-cancer : pourquoi mTor est décevant », via ULG réflexion, un article qui traite de la difficulté d’empêcher la prolifération cellulaire du cancer ;
- « Cancer : sur la piste de miR-503 », via ULG réflexion, un article présentant une possible voie de détection et de lutte contre le cancer s’appuyant sur la présence de micro-ARN.









 )
)
 (j'écris la moitié du temps en anglais, ou cet(te?) espace n'est pas nécessaire, donc j'ai perdu le réflexe)
(j'écris la moitié du temps en anglais, ou cet(te?) espace n'est pas nécessaire, donc j'ai perdu le réflexe)


