- Le point sur les stats des billets
- GitHub 10-12 : Marty McFly, compter les smartphones, supprimer vos comptes
Très longtemps sur le Site du Zéro je me suis accroché à son pendant "scientifique", dès qu’il a ouvert. Les forums étaient finalement assez bien garnis pour être auto-suffisants. Et je me suis mis à tanner tout les intervenants sur ce forum (Pierre_24 était l’un des leurs), c’était il y a de ça 7 ans. Il y a 7 ans je me suis intéressé aux sciences mais à la chimie plus particulièrement. J’ai eu l’occasion depuis d’organiser une bibliothèque virtuelle et physique de livres plus intéressants les uns que les autres :
- De la Cosmétologie
- De la Neuropharmacologie
- De la Pâtisserie et même un ouvrage sur la Panification
- De la Chimie Pharmaceutique
- De l’Œnologie
En bref j’ai tenu à découvrir la chimie dans toute sa splendeur et à découvrir les applications les plus communes : après tout, où se trouve la chimie dans notre quotidien ? Tout cela parce qu’en fait, quand j’étais plus jeune, quand je n’avais pas encore mis le pied dans la chimie par moi-même, personne n’était venu me dire à quel point la chimie pouvait être fondamentale.
Et finalement, jusqu’où va la chimie ? Ma liste de bouquins plus haut n’est pas exhaustive, y a-t-il une limite ? Jusqu’où va le métier de chimiste, s’il peut fabriquer des plastiques, étudier le pain et le vin ? Ce sont là des questions auxquelles très peu de non-initiés peuvent répondre. Certes sur ce site nous sommes tous scientifiques et curieux (vous ne liriez pas ces lignes si vous ne l’étiez pas) donc vous avez déjà surement un à priori sur la question. De plus votre curiosité à vous tous va surement fausser l’expérience que je vais faire, mais réfléchissons ensemble à cette question tout de même :
Y a-t-il une différence entre une vitamine C extraite d’une orange, purifiée à 100% et de la vitamine C synthétisée en laboratoire, puis purifiée à 100% ?
Note : Pour les besoins de cette expérience de pensée on doit admettre que quelque chose soit purifiable à 100%.
Vous seriez curieux de savoir que plusieurs élèves et étudiants en science (de la à Bac ) se sont trompés à cette question. Et ce n’est pas rassurant, cela alimente l’idée que finalement personne ne vient parler de ce qu’est la chimie, lorsqu’on l’étudie. Bien sur, on parle de chimie quand on étudie la chimie, mais on ne parle pas de ses implications, ni de ses tenants.
La chimie répond elle-même à cette énigme si nous la comprenons. Une molécule n’est pas une copie artificielle d’une entité végétale différente d’une molécule (si ça vous semble évident, tant mieux, mais pas mal de personne ne le savent pas). La réponse à l’énigme précédente est donc : Non il n’y a pas de différence.
Je prépare donc ce billet dans le but de vous amener à éliminer vos faux préjugés sur la chimie. Je ne m’engage pas à vous délivrer une vérité, mais un avis. Néanmoins ce que je raconte tient de mon vécu donc il devrait y avoir du vrai dans les conclusions que j’en tire. Puis t’façon j’suis là pour foutre la m**de.
- Pourquoi l'esprit commun est-il mal alimenté autour de la chimie ?
- Concrètement quelles sont les différences avec la vraie chimie ?
- La chimie est une science visuelle
- La journée d'un chimiste organicien
Pourquoi l'esprit commun est-il mal alimenté autour de la chimie ?
Pourquoi l’esprit commun est-il mal alimenté autour de la chimie ?
Avant de parler du métier de chimiste tel qu’il est, j’aimerais d’abord répondre à cette question. Elle me semble cruciale car elle est le reflet de notre société et de nos accords tacites avec l’illusion.
Les sciences sont dures
J’aurais pu me noyer dans le jeu de mot "les sciences dures sont dures" mais alors les sciences "molles" me seraient tombées dessus, et vu que j’aime tout le monde je m’abstiens les copains
Les sciences sont compliquées car honnêtement on ne voit pas ce qu’on fait. Je ne dis pas que nous agissons à l’aveugle, loin de là. Mais le rapport à l’abstraction est souvent énorme quand on débute, on doit admettre qu’il y a des particules qui nous composent, mais sans les voir parce qu’elles sont trop petites. On doit aussi admettre qu’une table applique une force sur un objet posé sur elle ; pour beaucoup ces concepts sont contre-intuitifs. Et je ne peux pas les blâmer.
J’ai personnellement toujours cherché à imager les problèmes, faire des schémas, des graphes, des diagrammes, des dessins. Tout ça dans le but de perdre au mieux ce rapport à l’abstraction et de gagner en concret. C’est d’ailleurs pourquoi j’offre souvent mon aide pour créer des images sur divers contenus du site.
Je remercie d’ailleurs tout ceux qui ont bien voulu accepter mes dessins/animations, j’espère qu’œuvrer ensemble sert à créer un tout cohérent.
En bref, les représentations graphiques sont importantes, il faut se représenter les choses. Et c’est pour ça que tout cloche ! J’ai vu beaucoup de professeurs dessiner très mal ce qu’ils voulaient représenter. Mais mal ne veut pas dire inefficace. Le flux de connaissance () n’est pas nul à ce moment .
Cette équation est belle pour bien des raisons, l’attention c’est à nous de la donner (elle est reliée à une notion d'effort) et le temps nous en disposons tous.
Mais il y a une chose qui n’est pas montrée dans cette équation, ce que j’appellerais : le fourvoiement de la connaissance. Qui transformerait presque en un flux de connaissance inutile, voire parasite !
Le fourvoiement quotidien
Ce fourvoiement c’est lorsqu’on vous impose un problème et que quelqu’un vous dit comment le résoudre en ne vous plaçant pas au bon endroit.
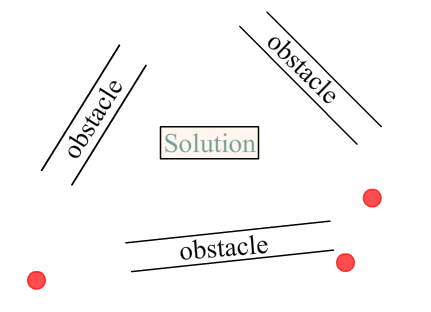
Imaginez que vous soyez ce point rouge, et que toute votre vie le seul à priori qu’un individu vous ait donné sur la résolution d’un tel problème soit cette emplacement :

Vous partiriez perdant. Quoi qu’il arrive vous avez été fourvoyé par un placement de départ non-avantageux. Et ça c’est pire que "rien". Je souligne ça que j’ai déjà entendu dire d’un directeur de collège :
Pour nous il n’y a pas de situation qui soit pire que de n’avoir personne face aux élèves. Source : Prof à la gomme, sérieusement ? (25:10) (Envoyé Spécial)
Je trouve ça atrocement faux, car ce fourvoiement va demander à l’élève de désapprendre cette situation de départ. Où vous seriez-vous placé par défaut pour entrevoir la solution à ce problème ? On ne le saura jamais car vous venez d’être parasité par une mauvaise expérience, un fourvoiement.
Et ça finalement, c’est grave car ça fait perdre du temps et de l’espace de stockage. Et ça demande même un effort additionnel car se remettre en question c’est toujours difficile. Ça demande du recul aussi !
Ça demande d’avoir un regard critique sur :
- la première personne à vous avoir mal expliqué la chose
- la compréhension du problème en lui même.
Ce recul ne fera que vous retarder dans l’apprentissage. Le prochain guide que vous aurez devra d’abord gagner votre confiance avant d’arriver à vous déplacer de ce point de départ.
Mais je n’ai surement jamais été confronté à ça par rapport aux sciences, pourquoi me dire qu’on m’a fait me fourvoyer ? Peu de gens font du tort ?
Voyez-vous, aujourd’hui on est bombardés d’image, de publicités, de films et de séries. Il y a plusieurs de ces exemples qui n’ont fait que déconstruire la logique élémentaire. Nous avons tous subi ce fourvoiement.
Je prend l’exemple récent du film Prometheus. Au début du film nous pouvons y voir de l'ADN comme ceci :
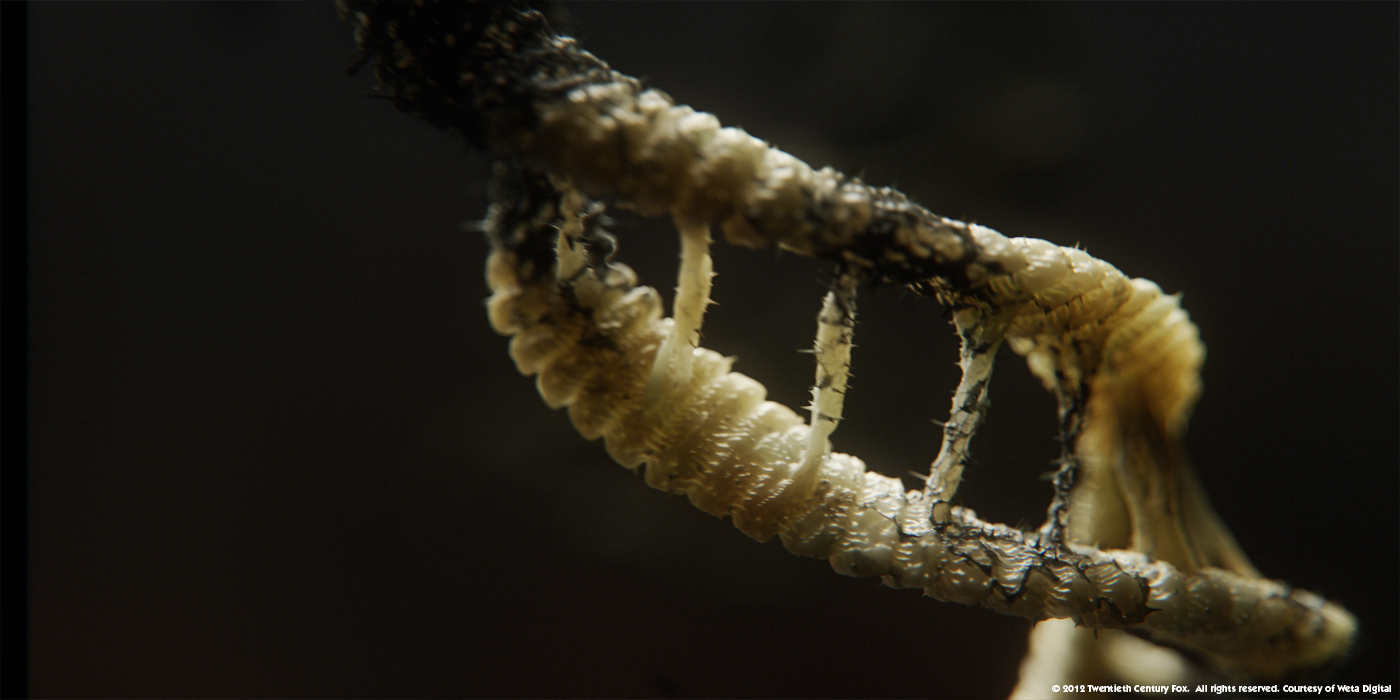
Qu’est-ce que vous pouvez me dire ? Mis à part que ça ressemble à une nouille avec des spaghettis ? Cette image rappelle quelque chose d’organique et d’assez peu tangible, qu’est ce que c’est que cette paroi jaune presque translucide ? Y a-t-il des molécules dedans ? Est-ce vivant comme une cellule ?
Un autre exemple si vous pensiez que ce cas était isolé, Spiderman 1 de Sam Raimi :

Et bien croyez moi, l'ADN n’est pas une cellule, n’est pas vivant, n’est pas si organique1 que ça.
L'ADN en plus d’être deux molécules, c’est surtout deux molécules non-liées ! Il y a un "espace" entre les deux brins ! Ce qui rend toutes ces images, qui s’incrustent dans nos fondamentaux, fausses ! Car sur ces images les bâtonnets transversaux sont soudés.
La première fois que j’ai vu qu’un brin d'ADN pouvait se dessiner, et ce, clairement, j’ai pété un câble. J’ai littéralement halluciné de voir à quel point il était simple de représenter de manière juste et cohérente l'ADN :
![Wikipédia commons] (https://upload.wikimedia.org/wikipedia/commons/2/2a/DNA_chemical_structure_cropped.png)
Vous voyez, même sur un feuille vous pourriez dessiner une séquence d'ADN. Les pointillés représentent des liaisons faibles qui font partie de "l’espace" entre les deux brins dont je parlais précédemment. En gros notre organisme sépare souvent ces deux brins car ils ne sont pas soudés entre eux ad eternam.
Bon en soit c’est dessinable, c’est fait de deux molécules : alors pourquoi diable personne dans la direction artistique des films (en dix ans, si on suit mes exemples) n’a fait changer les choses ?
Parce que les sciences sont dures, obscures et que personne ne sait ce qu’est réellement la différence entre une cellule et une molécule ? Je n’ai pas envie de croire à ça, mais pour dissiper tout les doutes je fais ce billet, je vais vous dire ce que fais un chimiste.
Note : si vous voulez du What The Fuck regardez Lucy de Luc Besson, on a le droit à un feu d’artifice dans le sang d’une personne. Comme si c’était ainsi que fonctionnaient des médicaments ou des drogues. Un feu d’artifice dans un milieu aqueux ? Sans que la personne n’en meure instantanément…
Ce scénario est quand même troublant. On a vraiment l’impression que ça pourrait être vrai. Source : un des scientifiques qui travaillaient avec Luc Besson sur Lucy
9 ans de travail sur le scénario, la rencontre avec des professeurs […] des gens qui s’occupent du cerveau de la moelle épinière des systèmes nerveux, voilà c’est beaucoup de recherche d’abord, d’abord pour pas être crétin… Source : Luc Besson lui-même sur BFMTV
- Définition 8 : Qui est organisé, qui implique une force centrale agissant, consciemment ou non, en vue d’une fin.↩
Concrètement quelles sont les différences avec la vraie chimie ?
Ah toute cette longue histoire pour vous parler de la chimie. Bah quoi ? J’vous connais, vous les lecteurs, j’ai tout intérêt à y aller molo pour ne pas vous perdre. Déjà que le titre ne fait pas vendeur (dès qu’il y a écrit chimie les gens fuient). Puis après tout, je peux me lâcher en terme de longueur, alors je me fais progressif dans le dialogue.
Le ménisque et la covalence
Ça c’est mon premier stéréotype. Non pas qu’il m’appartienne, mais c’est le premier auquel on fait référence quand je dis que je suis chimiste.
Ah ouais je connais, le truc avec le ménisque là (mimant de la main une courbe), avec la burette hein ? Puis t’as les électrons qui font des trucs et tout Source : pas du tout une caricature de ce que j’ai vu
Au lycée et au collège aujourd’hui, la chimie n’est pas mal enseignée. Dur à croire (?) Sachant que je crache beaucoup mon venin dans ce billet . Non elle n’est pas mal enseignée, car elle n’est pas enseignée.
Je prends pour exemple la filière (filière générale française), dont les élèves sont souvent dépeints comme étant les scientifiques du lycée. Et bien, dans leurs maigres heures, peu de chances qu’ils aient vu comment la chimie s’apprend (parce qu’il faut apprendre à apprendre la chimie, ça fera surement l’objet d’un autre billet) ni à quel point la chimie s’intersecte avec tout.
Alors heureusement, les élèves restent des élèves curieux et vont pouvoir se forger une image à travers leurs recherches personnelles. Mais ce n’est pas au programme d’enseigner ce qu’est la chimie. Et heureusement que certains professeurs se donnent du mal. Mais voilà, il y a plus de professeurs de physique-chimie issus d’études en physique que l’inverse. C’est ce que j’ai découvert, aléatoirement au cours de mon cursus : j’ai eu quatre professeurs anciens physiciens sur cinq professeurs de physique-chimie. des professeurs de physique-chimie de ma scolarité étaient des physiciens à l’origine.
Souvent, le cours de physique-chimie est un cours disparate, qui ne se ressemble pas d’un bout à l’autre de l’année scolaire. On utilise un jour une burette, mais un autre on va devoir nommer des hydrocarbures, puis enfin un jour on va fabriquer du savon. Sans le savoir, on vient de passer de l’analyse à la synthèse en passant par la nomenclature théorique.
Sans hiérarchiser ou organiser les différents pans de la chimie ou les différentes étapes d’apprentissage, il est clairement difficile de voir où on va avec ça. C’est important de toujours se situer géographiquement sur un organigramme.
Bon moi-même j’ai déjà eu quelques reproches sur ma manière un peu trop formelle de voir comment se découpe la chimie. La réalité c’est que la chimie est partout autour de nous. Et c’est pour ça qu’il est dur de la découper, de la cloisonner ou de l’entrevoir.
Un produit chimique
Pourquoi en a-t-on peur ?
C’est le deuxième stéréotype. Plus accusateur celui-ci par contre. A défaut d’être le reflet d’un non-enseignement de la discipline, il est le reflet des médias et de leur conception de la chimie. En fait je pense qu’il faut mettre Paracelse au cœur de cette partie :
Tout est poison, rien n’est sans poison. C’est la dose qui fait le poison Source : Paracelse, Grèce Antique
Ce père de la posologie nous informe que même l’eau peut nous tuer, selon la quantité. Ça fait souvent rire les gens quand je dis ça, mais la noyade ça tue. Alors l’eau, c’est naturel, c’est une molécule, c’est un produit chimique.
Si l’on suit la logique de Paracelse il nous faut connaitre la molécule pour connaitre sa capacité à tuer. Et ce qui tue, tue de manière proportionnelle. Je m’explique :

Pour tuer des insectes on utilise des poisons, neurotoxiques par exemple. Ces composés sont tout aussi dangereux pour nous. C’est simplement que la quantité de poison nécessaire à tuer un insecte est bien plus petite que celle pour tuer un homme.
Donc là est la première idée reçue : un produit chimique c’est toxique. Et bien, vu que tout1 est fait de molécules, alors tout est toxique. J’ai vu un jour une infographie extrêmement parlante à ce sujet :

Ce qu’il faut retenir de cette image c’est qu’en soit, les toxines sont naturelles, les venins sont naturels, et que certaines molécules artificielles ne sont pas mortelles. J’adore citer à ce moment là de mon speech le qui sauve des vies dans les accidents de voiture, ou des policiers lors de fusillades. Synthétique mais indispensable. Puis lorsqu’on sauve des vies, on peut parler des médicaments aussi ?
Enfin bon vous l’aurez compris :
- parler de produit chimique, c’est maladroit
- parler de produit de synthèse en mal, c’est aussi maladroit
Je vais maintenant prendre un peu le contre-pied en émettant une raison subtile pour laquelle un produit de synthèse est connoté comme étant dangereux. Ce n’est pas parce qu’on ne fait pas confiance aux chimistes lorsqu’ils fabriquent la molécule. C’est une question d'histoire.
Bien sûr les insectes produisent des poisons mortels. Mais cela fait des lustres que nous connaissons ces espèces, que nous les évitons car bon nombre d’individus sont morts. Un récit déjà bien détaillé.
Lorsque l’on synthétise une molécule inconnue, on fabrique un livre vierge. Une histoire teintée de rien si ce n’est de promesses lorsqu’il s’agit d’un médicament. Nous nous attendons à révolutionner le monde en fabriquant un nouveau remède, voire une panacée. Et au dernier moment lors d’essais cliniques : certains patients meurent car le temps n’a pas prévenu… Il n’y avait pas de siècle de morts par-ci par-là pour nous prévenir.
C’est le temps qui fait que les molécules naturelles sont plus connues. Beaucoup sont morts ou sont devenus fous pour nous alerter que le mercure est un métal toxique. Beaucoup meurent aujourd’hui pour nous dire qu’un millième essai clinique n’est toujours pas fructueux.
En fait c’est juste parce qu’on apporte une molécule et qu’on la teste, que cela a des conséquences désastreuses sur le direct, instantanément. Alors que pour les insectes, les champignons etc… Les pauvres malheureux mourraient seuls dans les bois et au fil des années les morts se sont accumulés sans qu’on ne les repère dans une vague médiatique.

J’aimerais ajouter que le mot naturel n’exclut pas la synthèse en laboratoire. Il faut savoir que l’arôme de vanille par exemple, la vanilline est soit :
- extraite (beaucoup de gousses de vanille à épuiser)
- synthétisée à moindre coût
Dans ces deux cas, le yaourt sera composé et noté avec "Arôme Naturel de Vanille". Cela peut sembler surprenant mais c’est parce qu’il n’y a pas de raison de différencier les deux produits. Pour qu’un yaourt porte "Arôme Artificiel de Vanille" il faut que ce soit une autre molécule que la vanilline qui soit mise en jeu. Notamment l'éthylvanilline, qui n’est plus la même molécule, qui n’a pas exactement le même goût que la molécule initiale mais qui possède une intensité 1 000 fois2 supérieure.
La chimie est une science visuelle
Voilà, nous avons réussi à tuer quelques préjugés. Je pense vous avoir laissé malgré moi une trace de mon amertume à travers les précédentes lignes. Alors faisons une pause, parlons poésie, parlons enfin de la chimie en étant moins factuels.
Comment imagine-t-on les sciences ?
Pour les sciences molles je ne pourrais pas répondre avec assez de recul et de bagage pour savoir comment les gens les voient. Je vais essayer de parler au plus général mais je resterai articulé autour de la physique, la chimie et les mathématiques.
Quand je parle de mes travaux à quelqu’un, il est souvent étonné de ne pas me voir lui citer des équations complexes faisant appel à des théorèmes aux noms effrayants. Le dernier stéréotype de la journée, le savant fou, je vous le promets.
Dans l’obscurité d’une salle avec un tableau noir on m’imagine verser des liquides colorés et fumants dans des fioles de formes variées. Je m’écrirais alors Eurêka si l’odeur de la solution me plait, sans analyser quoique ce soit j’aurais eu ma réponse. Car après tout, au tableau seraient encore griffonnés deux trois lettres grecques et des symboles mathématiques à moitié effacés.
Alors voilà, non je ne me réfugie pas dans des équations, aussi majestueuses soient-elles. Je ne me retrouve pas face à des tableaux de vingt colonnes et milles lignes de valeurs à interpréter. Que fait alors un scientifique ?
Et bien nous apprenons d’abord à lire, mais lire d’une manière cryptée, complexe, les règles de la nature. On ne peut pas faire sans. Puisqu’on ne joue pas avec la nature, mais qu’on se plie à ses lois et fondements.
Mais il y a aussi le jeu, comme lorsqu’on a pu trouver amusant de trouver au détour d’une équation de type collège. Pour moi c’est sûr, c’est amusant de trouver comment faire une molécule et de confronter mes chemins de synthèse avec d’autres chimistes. C’est d’ailleurs pour ça que tout les ans un nouveau ouvre un bal, puis un autre, puis un autre.
Pouvons-nous décrypter aussi ?
Bien sûr et c’est même l’objet de cette sous-partie; vous donner des clés visuelles pour comprendre comment peuvent se lire certaines chimies.
L’ébullition
Un phénomène que tout le monde connait un minimum, et qui est très lié à la structure des molécules. Alors pour petit rappel :
- Un solide est organisé, serré
- Un liquide n’est pas organisé, mais est serré
- Un gaz n’est ni serré, ni organisé
Lorsqu’on chauffe on passe de et ensuite de

L’ébullition (ou vaporisation ici) est un phénomène dit "de changement d’état". Les états de la matière sont régis par des constantes, je prends pour exemple l’eau :
Ces températures sont totalement relatives à la taille de la molécule (pour peu qu’on analyse deux molécules plutôt proches). On parlera alors de famille de molécules comparables.
Comparons ce qui est comparable. Les alcanes, famille de molécule formée de carbones et d’hydrogènes avec des liaisons simples, sont assez simples à dessiner et à comparer alors j’vais vous montrer ça pour que vous ayez une illustration des comparaisons que l’on puisse faire.

Voilà les 5 alcanes les plus simples, on voit qu’on peut rajouter, comme ça, des chaînons encore longtemps. Ces molécules étant de plus en plus lourdes il faudra plus d’énergie pour les transformer de liquide à gaz. Imaginez qu’on doive porter ces molécules pour les désolidariser et les soulever hors du liquide pour les mettre dans l’air ? Plus c’est lourd plus il faudra de force, autrement dit la température devra être haute.
La température est relative à une énergie thermique. C’est la traduction d’un niveau d’agitation des molécules. D’un liquide à un gaz les molécules ne sont pas "agitées" de la même manière. Dans un liquide les molécules sont plus serrées que dans un gaz donc leurs degrés de liberté/déplacements ne sont pas les mêmes.
- Il nous faut une énergie relative à la masse de la molécule
- Et une énergie relative aux interactions que ces molécules ont entre elles (à l’état gazeux on considère souvent qu’il n’y a pas d’interactions)
C’est la combinaison de ces deux énergies qui forme une température de changement d’état. Je vais vous présenter la variation de la température d’ébullition () en fonction de l’indice (nombre de carbone).
avec un

Ce qui est intéressant ce n’est pas d’en arriver au graphe. L’idée c’est qu’à l’œil on peut savoir, pour deux molécules quasi-identiques, ou de la même famille (ça, ça demande un œil un peu aguerri) si la molécule est plus ou moins facile à transformer en gaz.
La Vanilline
Là on est dans la branche de la chimie organique (ma passion). Dans cette branche on s’occupe de la forme et des groupements de la molécule (et de comment nous la fabriquons). On a vu plus haut qu’il existait deux arômes de vanille. La Vanilline et l'Ethylvanilline. Voici les deux molécules :
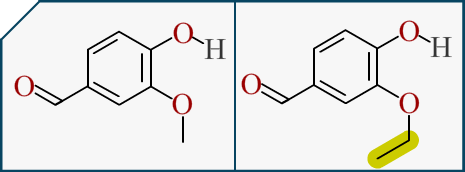
La différence entre les deux molécules réside dans la longueur du chaînon, surligné en jaune ici. Donc on sait que leurs formes sont quasi-identique. Les deux molécules possèdent un gout de vanille mais subtilement différent.
Donc la différence de gout doit venir de la longueur de chaîne et le goût de la vanille doit venir de la partie fixe, le centre de la molécule. On retrouve ça sur beaucoup de molécule.
Nous avons un autre indice maintenant, il faut beaucoup moins de d’éthylvanilline pour avoir l’odeur ou le goût de vanille. Cela signifie que l’interaction entre la molécule et nos récepteurs marche mieux quand la chaîne est longue !
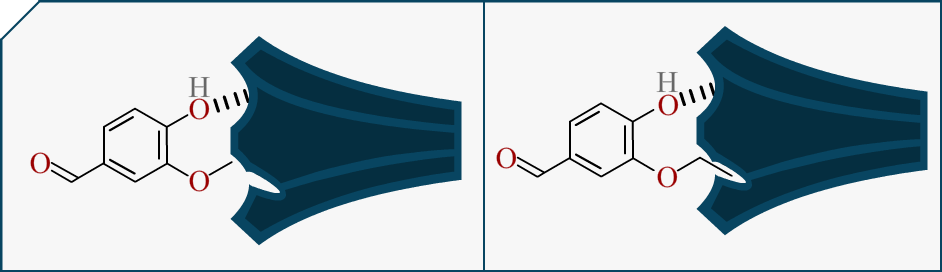
On voit sur ce schéma qu’on peut, surement, mieux imbriquer les récepteurs avec l’Ethylvanilline que la Vanilline. Cela est directement lié à l’intensité du signal (et à sa nature mais passons). Ceci expliquerait pourquoi ce changement de chaîne impacte notre perception.
Spectre UV-Visible et Diagramme électronique
Un spectre UV-Visible est le spectre d’absorption ou d’émission d’un composé. Un composé peut être coloré pour plusieurs raisons ; l’une d’entre elles est une excitation des électrons.
Dans une molécule, une liaison est faite de électrons, et une double-liaison est faite de , ces liaisons peuvent interagir avec la lumière car la lumière peut frapper si fort ces électrons qu’ils vont se mettre à augmenter en énergie potentielle.
Une énergie potentielle est une énergie qui n’est pas utilisée instantanément, c’est une notion d’emmagasinage de l’énergie. Si vous tenez votre stylo à du sol, il aura une énergie potentielle proportionnelle à l’altitude et à la gravité terrestre, car si vous le lâchez il relâchera automatiquement cette énergie.
Et bien pour les électrons c’est identique : ils montent en altitude grâce à l’énergie transmise par la lumière. Lors de cette excitation ils gravissent plusieurs états.

Ici on voit un électron sauter de son énergie fondamentale jusqu’à un état d’excitation , ce bond lui fait gagner en altitude. Vous voyez où je veux en venir ?
Maintenant que l’électron possède une énergie potentielle, il a la capacité de restituer de l’énergie. Cette restitution se fait sous forme de rayonnement (comprendre par là, émission de lumière et chaleur).
La lumière incidente, celle qui a excité notre électron au départ pouvait être à peu près n’importe quelle couleur de lumière. Mais le saut en parachute que va faire notre électron va conduire à une lumière spécifique, presque incomparable. Cette couleur propre au composé peut même servir d’outil d’analyse (surtout dans le cas des métaux).
Nous savons donc comment la lumière interagit avec une molécule. Mais notre composé sera-t-il toujours de la même couleur, peu importe la lumière incidente ?
Il y a des exceptions précises : lorsqu’un objet est orange, il absorbe en réalité du bleu. C’est le système des couleurs complémentaires :

Pour expliquer les cas de figure je vous fais un tableau pour un composé qui absorbe du bleu :
Lumière incidente | Aspect de l’objet |
|---|---|
Blanche | Orange |
Bleu | Noir |
Orange | Orange |
Noir |
-
Une lumière blanche possède tout le spectre lumineux, un arc-en-ciel en un faisceau lumineux. Donc il y a très certainement assez de bleu pour que l’objet l’absorbe et paraisse ainsi orange.
-
Lorsqu’on lui donne du orange par contre, il ne peut rien en faire, il ne l’absorbe pas, donc il ne peut rien émettre, d’où l’aspect noir.
Attention souvent le noir n’est pas considéré comme une couleur mais une absence de couleur. Car ce qui fait varier la teinte de blanc à noir s’appelle la luminosité et n’est donc pas déterminé par une couleur
Note : pour les composés polychromatiques ce genre d’expérience est plus compliqué, si une voiture est orange car on a mélangé du jaune et du rouge, alors les comportements lumineux seront plus complexes, ici nous ne parlions que de phénomènes monochromatiques.
Mais comment mesure-t-on une couleur ?
Une couleur c’est une plage de longueur d’onde (noté s’exprimant en distance ). Voici un arc-en-ciel avec les longueurs d’ondes notées en abscisses :
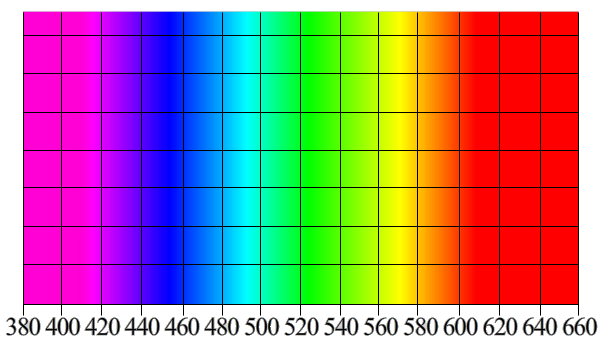
C’est bien pratique de savoir ça, car ça nous permet d’associer une couleur à une valeur physique tangible. Et ça associé au diagramme électronique que nous avons vu auparavant ça nous donne :
L’énergie () est inversement proportionnelle à la couleur (). Donc en connaissant le spectre du composé on sait à peu près la hauteur que parcourt l’électron lors de son excitation. On sait à quelle altitude il s’est élevé.
C’est plutôt chouette comme interprétation car on peut y appliquer cette formule tout bête pour obtenir :
- soit la couleur d’un objet si l’on connait ,
- soit l’inverse, déterminer si l’on connait la couleur monochromatique d’un objet.
D’une structure une couleur
Comme j’ai pu en parler sur les forums il y a une logique autour de la forme d’une molécule et de sa couleur. Je disais que les électrons constituaient les liaisons chimiques souvenez-vous. Et bien les liaisons doubles sont très sensibles aux phénomènes photo-électriques, car elles sont plus garnies en électrons.
Prenons un cas concret, une molécule qui va vous parler ou du moins qui devrait vous dire quelque chose : La . C’est bien sûr une molécule contenue dans la carotte, on va juste la dessiner là, avec sa cousine ().
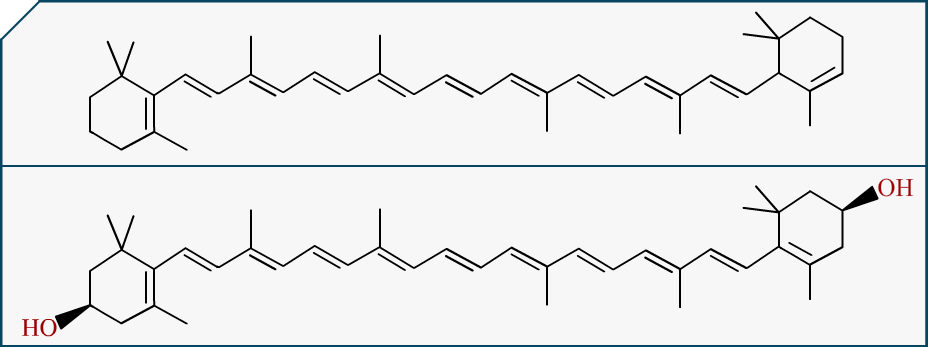
On voit qu’elles sont cousines pas trop éloignées hein, ça va. Ça reste dans la famille. Bon et bien si on regarde ce que le carotène représente sur un graphe où sa couleur est détaillée, nous obtenons ce beau spectre d’absorption :
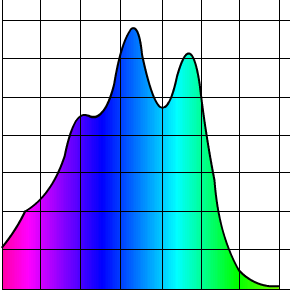
Alors ça absorbe pas mal dans le bleu et le turquoise, la hauteur du pic c’est la valeur dite d’absorption (). Bon à priori il n’y a pas ce genre de couleur dans la carotte et c’est là qu’on se rappelle : il faut inverser la couleur d’absorption pour obtenir celle d’émission. Personnellement j’utilise Paint. C’est tout bête, je prends le spectre d’absorption et j’applique Ctrl + i (i = inverse). Ce qui a pour résultat d’inverser les couleurs et nous obtenons alors le spectre d’émission du .
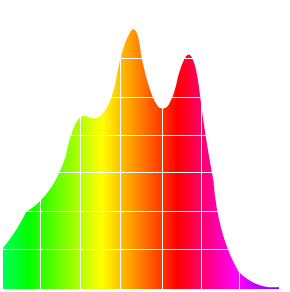
Ah bah là nous y sommes. Des couleurs chaudes qui nous rappellent la carotte (la carotte est chaude ), nous avons là deux pics, un orange et un rouge. Cela nous rappelle bien sur la couleur orange de la carotte, le carotène est en fait ce qui colore ces tubercules.
D’ailleurs le carotène est responsable de la couleur des feuilles d’automne. En fait le vert naturel des feuilles vient de la chlorophylle puis une fois tombée la feuille se détériore progressivement et les molécules ne sont plus conservées.
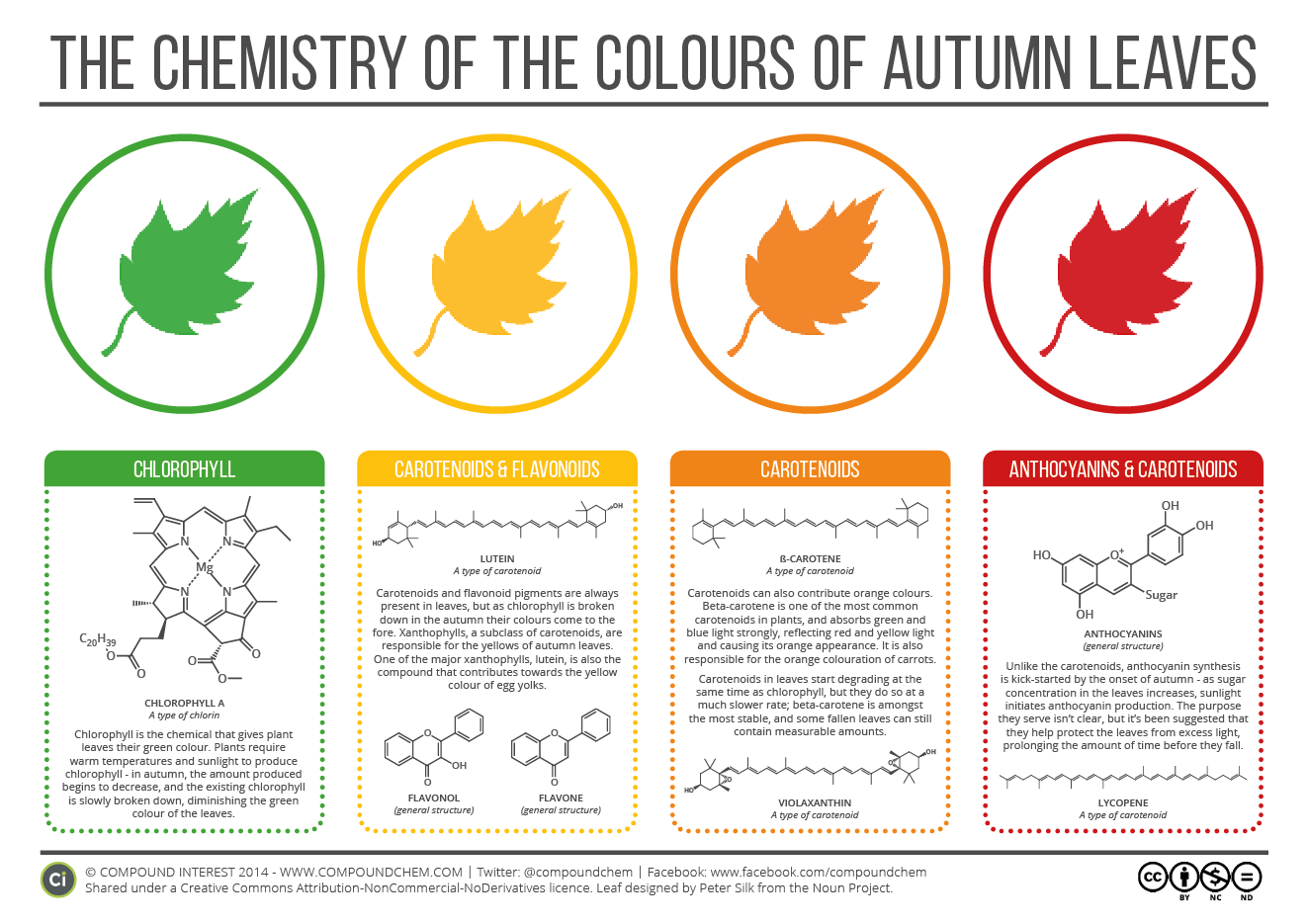
Parlons maintenant de l’autre molécule, la xanthophylle. Cette molécule est différente structurellement du carotène. Pour pouvoir parler des priorités extrapolables des molécules il faut simplement regarder les différences entre les structures et les spectres des deux molécules.
Petit rappel :

Mis à part l’apparition de , que pouvez vous noter d’autre ?
Une des liaisons doubles est disposée différemment d’un dessin à l’autre. On remarque une certaine harmonie dans le deuxième dessin : la molécule possède une alternance de double liaison une fois sur deux de part et d’autre de la chaîne. Or sur le carotène cet enchaînement saute une intersection… Et cela a de grosses conséquences…
En chimie organique on appelle une molécule ayant une alternance de double liaison une fois sur deux un système conjugué. Plus un système est conjugué plus la molécule est stabilisée. Cela fait donc du carotène une molécule moins conjuguée que la xanthophylle.
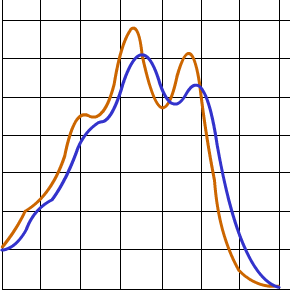
Je vous montre là une superposition des courbes (pas d’arc-en-ciel ici, juste pour comparer géométriquement les courbes) du carotène et du xanthophylle. Et bien on voit qu’il y a un léger décalage vers la droite et un abaissement des pics.
On peut interpréter alors qu’un système hautement conjugué conduit à un graphe décalé vers la droite au niveau des couleurs par rapport à un analogue. Un tel effet qui décale le spectre du violet vers le rouge s’appelle un effet . Et c’est exactement ce que nous constatons entre le carotène et le xanthophylle.
Il existe aussi un nom pour l’effet chromatique d’abaissement des pics, c’est un effet dit . Voici un schéma récapitulatif des déplacements sur le spectre :

Pour le plaisir des yeux voilà les deux spectres d’émission colorés, à gauche le carotène, à droite le xanthophylle :

Comment expliquer que l’ajout d’une double liaison interfère avec la couleur ?
Tout cela est donc relié à la conjugaison, je vous disais plus haut qu’elle avait un rôle , et bien là nous le voyons très bien. En ajoutant une double liaison bien placée nous avons un léger phénomène . Donc on peut voir à la tête d’une molécule si elle est colorée ou non, selon le nombre de doubles-liaisons. Tout cela reste du pifomètre mais ça donne de bonnes indications.
Groupement et Spectre Infrarouge
En chimie, nos molécules ont des parties caractéristiques appelées . Ces fragments sont distinguables car ils ont des particularités, notamment sur la réactivité de la molécule. Pour citer le plus connu, l’alcool. En fait "les alcools", c’est une famille de molécules, dont bien sur l’alcool que nous buvons est l’un des rares comestibles. C’est l', qui est une molécule bien précise (donc dire "je bois de l’alcool", dans le jargon courant ça passe, en chimie stricto sensu ça n’a pas de sens). Mais vous connaissez aussi bien le qui est souvent utilisé, ou encore le :
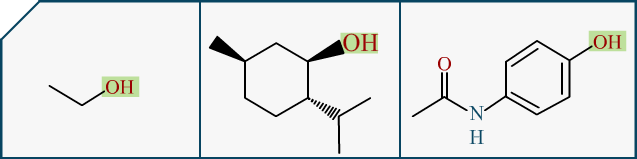
Pour les chimistes, j’avoue faire un amalgame entre phénol et alcool, mais ça reste une approximation visuellement vraie. Il suffit d’un peu de mésomérie pour expliquer les différences entre les deux groupements.
Bon du coup on peut reconnaître visuellement les groupements fonctionnels, mais comme on l’a vu, en chimie, on utilise surtout des graphes. Ces derniers s’analysent un peu "à la tête du client" il n’y a pas forcément d’outils mathématiques à maîtriser pour les interpréter grossièrement (mdr… vu ce que j’y pige aux maths).
Et bien il existe un type de graphe appelé spectre infrarouge qui est une liste complète des groupements contenus dans une molécule. C’est plutôt génial car c’est l’une des techniques qui traite directement de la nature des atomes et de l’ensemble qu’ils forment. Couplé avec d’autres méthodes (RMN, Spectrométrie de Masse…) ça devient très rapidement facile de savoir, de source sûre, quelle molécule nous avons en face des yeux.
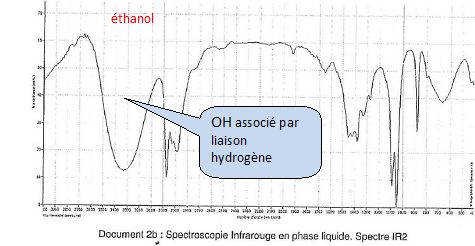
Si l’on garde le groupement fonctionnel alcool, je peux facilement vous apprendre à reconnaître un spectre infrarouge d’une molécule appartenant à la famille des alcools. A gauche des spectres relatifs aux molécules possédant un , à droite une liste de graphes de molécules n’en contenant pas :

Le but de ces exemples est de définir quelles sont les différences visuelles entre un spectre provenant d’une molécule ayant un d’une molécule n’en ayant pas. J’espère que vous aurez, par vous même, deviné que la protubérance arrondie très à gauche des spectres est justement la "bande de signature" des fonctions alcools.
Aller plus loin
Pour aller plus loin il va falloir passer par de vraies explications, de vrais cours. Ici j’essaye de faire court (si si, j’vous assure ) donc je ne m’étends pas tant que ça sur le sujet. Mais dans mon domaine de prédilection on se retrouve souvent à dessiner.
On dessine des plans et des voies de synthèses (conception de molécule) et dans ces moments là, tout passe réellement par le dessin. Et voir comment se construit une molécule, c’est donc assez visuel : nous avons une petite molécule autour de laquelle vont se greffer des parties jusqu’à en donner une plus grande.
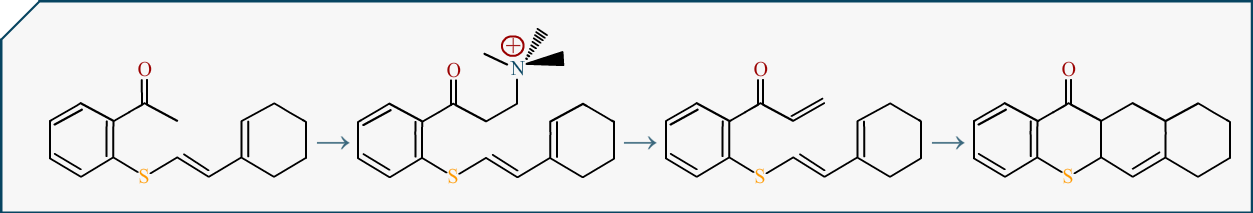
Du coup cela vous demanderait de vraiment vous intéresser à la chimie pour en comprendre les codes. Mais j’espère que vous me croirez sur parole à défaut de vous investir.
La journée d'un chimiste organicien
Pour avoir eu l’occasion de travailler comme technicien chimiste dans 3 laboratoires de recherche différents, j’ai pu parfaire ma connaissance du quotidien d’un chimiste. Je sais à peu près ce que ça donne jour après jour.
Après je fais partie d'UNE branche de la chimie, qui est appelée la chimie organique et cela fait de moi un chimiste organicien. A contrario Akio serait un chimiste analyticien, Pierre_24 un chimiste théoricien, de même qu’il existe des chimistes dits polyméristes.
Bref je fais partie d’une petite branche de la chimie. Dans cette branche nous fabriquons et conceptualisons des molécules. Pour des buts variés, j’ai eu l’occasion de créer des catalyseurs, de tester des réactions de catalyse jusqu’à ce que ça marche et aussi de créer de la manière la plus générique possible une molécule.
Bon ces termes peuvent vous paraître un peu flous et c’est normal . Tout cela pour dire que ces trois travaux de la chimie m’ont apporté des calendriers sensiblement identiques.
 Conceptualisation
Conceptualisation
Nous cherchons à avoir une molécule d’une certaine forme. On est précis, on tente d’avoir cette molécule le plus logiquement possible. Pour cela on utilise des outils de reverse engineering, du biomimétisme. Durant la recherche de la forme et de l’obtention de la forme de la molécule il y a des étapes clés.
-
Si on fabrique un catalyseur dit énantiosélectif sa forme doit être celle d’un réceptacle capable d’emprisonner une taille de molécule dans un sens précis. La encore la chimie se fait à l’œil. La cavité est visuelle.
-
Si on fabrique une molécule capable d’interagir avec un organisme, les interactions que la molécule va avoir avec les récepteurs dans lesquels elle va s’imbriquer sont fondamentales.
Tout cela est une question de forme, de taille, de groupement, certes cela demande des prérequis en lecture de molécule mais quand bien même c’est assez concret.
 Le plan
Le plan
On planifie ensuite comment vont s’organiser les différentes journées, à quel moment quel réactif doit-être commandé pour lancer une réaction qui demande un réactif jeune (qui n’ait pas vieilli 8 ans au fond du labo…). Et on essaye de se mettre des objectifs. Certaines réactions durent toute une nuit, voire plus.
Puis, la molécule de départ, il faudra surement en re-fabriquer car on la consommera à tester des trucs dessus au fur et à mesure.
A chacune des étapes expérimentales on perd un peu du composé car par exemple la synthèse de n’est pas connue et que trouver le bon ratio est compliqué et demande plusieurs tests. On obtient des fois en milieu de projet des rendements très bas ce qui nous oblige à mettre en attente la recherche et continuer à fabriquer du produit à (si c’est la synthèse de le problème). Ce sont des cas de figure à prévoir.
Donc une fois qu’on sait faire ça, on passe à la manipulation.
 Le laboratoire, ce n’est pas qu’au bureau
Le laboratoire, ce n’est pas qu’au bureau
Une fois qu’on connait sa théorie sur le bout des doigts ainsi que son planning, on essaye d’avoir le moins de retard possible et on bosse. On commence par faire la vaisselle des verreries à utiliser dans la journée.

On récolte à droite à gauche les réactifs du voisins, on les réunit, on les met dans l’ordre, on vérifie les paramètres température et couleur. Tout est noté dans un cahier pour déléguer sa mémoire sur un support. Généralement le cahier reste la propriété du laboratoire. Et sera relu par les personnes qui travailleront sur des molécules similaires à vous.

Le long d’une réaction, on fait généralement un suivi pour vérifier que tout se passe bien à l’intérieur. On ne navigue pas totalement à l’aveugle mais ça ne sert à rien d’arrêter une réaction au bout de 2 heures si au bout de 20 minutes elle est déjà finie.

Plus tard, on extrait la molécule d’intérêt de ce milieu réactionnel et on la sépare à l’aide d’une technique de purification.
 La purification
La purification
Lors de la purification, selon la technique (souvent dite chromatographique) on a plus ou moins d’efforts à fournir. Notamment en chromatographie la taille de la colonne importe beaucoup, et du coup la quantité de solvant à y mettre aussi.

Finalement c’est un métier physique. Car là sur cette image la colonne fait un bon mètre, il faut transporter la bouteille de solvant de 10 litres au dessus de la colonne pour la remplir soigneusement. Une colonne en verre c’est fragile, la bouteille de solvant lourde, j’vous laisse imaginer le doigté qu’il faut.

Des fois les colonnes sont larges et nous font de plus en plus penser qu’on essaye de compenser quelque chose.
Au final en fin de colonne chromatographique on obtient un composé pur qui peut être cristallisé. Les cristaux peuvent être de couleurs variées, de formes variées aussi.

Bon j’vous arnaque un peu car ces cristaux-ci n’ont pas été obtenus par chromatographie mais par recristallisation (un autre processus de purification).
 Analyse
Analyse

Lors de l’analyse, il se passe à peu près ce que j’ai détaillé plus haut. Nous avons des graphes auxquels nous n’avons pas besoin d’appliquer de savants calculs pour obtenir une réponse. Avons-nous la molécule attendue ou non… Tout cela est visuel.
 Le soir
Le soir
Souvent on évite de faire les analyses le soir, car après tout il faut bien un temps pour la bière non ?

Vous me ferez une colonne. Source : Ma cheffe de laboratoire me disant ça en partant, vendredi soir à 16h (la colonne prend au moins 3h)
Tu me distilleras ça avant d’y aller. Source : Un collègue de laboratoire me disant ça en partant, vendredi soir à 18h (la distillation a pris 2 heure pour ne pas fonctionner, plaque chauffante défectueuse.)
Si vous êtes arrivé là, vous faites partie des courageux qui ont lu mon avis sur la chimie. Ce billet est long et subjectif, mais selon moi il forme un tout qu’il faut garder ainsi pour des raisons de pré-requis inter-parties. Il se peut que plusieurs personnes soient en désaccord avec ce que je décris mais c’est ma manière de voir les choses.
Le fourvoiement que je décris est issu de ma mésentente avec les gens responsables de ce que l’on voit. Quand je n’étais pas dans la chimie, j’avais des idées pré-conçues qui venaient en partie de toutes ces simplifications (ou modèles erronés). Et lorsque l’on présente un modèle erroné, on le dit, merde.
Le fait d’interpréter pédagogiquement la chimie comme une science visuelle est un défi car ce n’est pas simple à démontrer sans tutoriel. Donc le peu d’exemple que je vous ai donné là ne sert que superficiellement le propos. En réalité il y a bien plus d’événements concrets qui me font pencher vers cette méthode d’appréhension de la chimie.
Le métier de chimiste que je décris était une vue de ce que j’ai observé, vécu, mais n’est pas une vérité fondamentale.
un chimiste n’est pas un autre.
Je tiens à remercier les relecteurs suivants qui m’ont apporté leur soutien et leurs avis sur ce billet : GriffeDeKoala, Pierre_24, Rezemika. Merci à Sciencationelle pour les photos de labo tiré de son instagram.
Une pensée spéciale pour GriffeDeKoala qui me suit depuis maintenant plusieurs années pour la relecture de mes cours/articles et maintenant billet. C’est grâce à l’équipe que nous formons que le contenu publié possède une cohérence pédagogique.




 . Enfin, merci pour cet aperçu sur les pensées et le vécu d’un chimiste.
. Enfin, merci pour cet aperçu sur les pensées et le vécu d’un chimiste.

 On ne se rend pas compte de la difficulté de certains choses. Quand on ne sait pas ce qu’on cherche, on ne sait pas ce qu’on trouve.
On ne se rend pas compte de la difficulté de certains choses. Quand on ne sait pas ce qu’on cherche, on ne sait pas ce qu’on trouve.