- Trouvons quelques hypothèses possibles
- Le cyanure, l'absorption du glucose et l'extraction du dioxygène par les tissus
Nous allons donc partir de notre première hypothèse : le cyanure, en empêchant l’absorption intestinale du glucose, de l’eau (et sans doute d’autres choses), nous tue.
À l’issue de ce chapitre vous serez normalement en mesure de :
- Comprendre comment le glucose est absorbé au niveau intestinal ;
- Comprendre les régulations hormonales qui maintiennent une glycémie constante mais qui oscille autour d’une valeur consigne ;
- Comprendre ce qu’il se passe lors d’un jeûne prolongé ;
- Comprendre comment est assurée la production d’énergie dans le monde du vivant.
C’est parti !
- L'absorption intestinale du glucose et la régulation de la glycémie
- Le glucose : molécule permettant la formation d'énergie sous forme d'ATP
- Revenons sur notre cyanure
L'absorption intestinale du glucose et la régulation de la glycémie
Mais quel rapport avec le cyanure tout ça ? Vous allez voir.
Si le cyanure est censé inhiber l’absorption intestinale du glucose et que c’est précisément cela qui cause la mort alors il est logique d’aller voir ce qu’il se passe dans le corps côté taux de glucose sanguin.
Une prise de cyanure engendrerait alors, selon notre hypothèse, une hypoglycémie, c’est-à-dire une diminution du taux de glucose (la glycémie) sous la valeur normale qui est d’environ 1,06 g/L de glucose à jeun. Celle-ci devrait, à terme, conduire à la mort ?
Juste après un repas
Le taux de glucose augmente dans le plasma sanguin suite à son absorption intestinale.
Les cellules situées sur la paroi intestinale, appelées cellules épithéliales et prenant le nom d’entérocytes, permettent son absorption vers le sang, le mettant ainsi ensuite à disposition du reste de l’organisme. Ces cellules possèdent à leur surface un transporteur spécial appelé SGLT (pour sodium-glucose linked transporter), ce qui signifie que le transport du sodium et du glucose est lié. Les deux composants sont transportés dans le même sens vers l’intérieur de l’entérocyte : même sens c’est ce qu’on appelle un symport.
Rappelez-vous la partie précédente : pour que ce transport se fasse sans énergie il faut que les deux composants (pour ne pas dire molécules, le sodium étant un cation ici) soient plus concentrés dans l’intestin qu’à l’intérieur de la cellule sinon il faudra utiliser de l’énergie pour faire ce transport. Alors qu’en est-il ? 
Si on regarde ce que nous dit la théorie : le sodium est plus concentré à l’extérieur des cellules qu’à l’intérieur (rappel de la partie précédente, grâce à la pompe Na+ K+ ATPase qui permet de conserver un déséquilibre des concentrations en sodium entre les deux milieux) donc c’est bon pour le sodium. Là où ça pose problème c’est pour le glucose, il est plus concentré dans les entérocytes que dans l’intérieur de l’intestin (on parle de lumière intestinale pour désigner l’intérieur de l’intestin, son contenu). Il est plus concentré dans les entérocytes puisque cela est en rapport avec la fonction de ces cellules qui est d’absorber le glucose, elles en accumulent donc beaucoup.
Ainsi l’absorption intestinale du glucose se fera selon un transport actif. Mais il ne consommera pas d’ATP cette fois-ci !
Eh oui. En fait nous vous l’avons volontairement caché jusque maintenant (pour ne pas vous encombrer trop la tête avant) mais il existe également 2 types de transport actif : ce qu’on appelle le transport actif primaire, celui qu’on a vu jusqu’à présent et qui utilise directement l’énergie de l’ATP par exemple et le transport actif secondaire, comme ici.
Le transport actif secondaire utilise l’énergie provenant d’une autre molécule, qui, elle, peut être transportée passivement. Ici qui est transporté passivement ? C’est le sodium. Donc ce transport actif secondaire va se faire en utilisant l’énergie contenue dans le gradient électrochimique du sodium. Nous l’avons vu dans la partie précédente, le sodium a tendance à entrer dans les cellules, au moins pour des potentiels membranaires physiologiques. Et cela car il porte une charge positive et est donc attiré vers l’intérieur des cellules, chargées négativement, mais surtout parce qu’il est plus concentré à l’extérieur des cellules, cela grâce à l’action permanente de la pompe Na+ K+ ATPase qui, elle, constitue un transport actif primaire car elle fonctionne avec l’énergie de l’ATP.
Nous voyons ainsi que le transport actif secondaire dépend directement du transport actif primaire.
Retenez ceci car c’est très important pour la suite. Notez-le bien quelque part.
Ainsi le glucose pourra entrer dans les entérocytes grâce à l’énergie du sodium.
L’image ci-dessous résume bien le mécanisme :
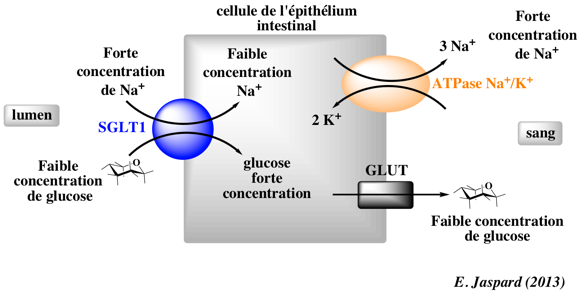
Le glucose et le sodium entrent donc dans l’entérocyte via SGLT de type 1. De l’autre côté de la cellule (en contact avec le sang cette fois-ci) le glucose pourra être transporté passivement car moins concentré dans le sang que dans la cellule. Ce transport passif se fait via un transporteur appelé GLUT, il existe plusieurs types de GLUT. Pour le sodium la situation s’inversera et il sera transporté activement via la fameuse pompe Na+/K+ ATPase. Cela permettra de conserver le déséquilibre des concentrations en sodium entre les milieux intracellulaire et extracellulaire. Ce même déséquilibre entretiendra donc l’efficacité du symport SGLT1 comme nous l’avons dit précédemment.
Que devient le glucose une fois dans le sang ? C’est l’objet de la suite du cours.
Avant même son absorption, lorsque le glucose était dans la lumière intestinale, une hormone nommée GIP a été synthétisée par l’intestin, celle-ci agit par la voie sanguine (dite endocrine) sur un autre organe très important de la régulation de la glycémie : le pancréas. Quand GIP agit sur le pancréas ce dernier sécrète de l’insuline.
L’insuline est une hormone hypoglycémiante, c’est-à-dire qu’elle a tendance à abaisser la glycémie quand celle-ci est trop élevée, typiquement juste après un repas. Elle fait baisser la glycémie en faisant entrer l’excédent de glucose sanguin dans des "cellules réserve" du corps : le tissu adipeux (le gras) et le muscle principalement. Ces deux tissus stockent le glucose en excédant après un repas. L’insuline agit en se fixant sur des récepteurs (des protéines) à la surface des cellules adipeuses et musculaires, cela les informe ensuite en quelque sorte qu’il faut faire entrer du glucose dans ces cellules. La glycémie diminue donc.
Mais l’hormone GIP, récemment découverte, n’est pas le principal déclencheur de la stimulation de sécrétion d’insuline par le pancréas. En fait quand la glycémie augmente il y a beaucoup de glucose dans le sang et par voie de conséquence dans les cellules elles-mêmes. Il y a donc beaucoup de glucose dans les cellules du pancréas chargées de la sécrétion d’insuline, elles sont appelées cellules bêta. Ces cellules possèdent à leur surface un canal potassique inhibé par l’ATP, c’est-à-dire qu’en présence de beaucoup d’ATP le canal est fermé et la cellule aura tendance à se dépolariser légèrement. Nous verrons plus tard dans ce cours que le glucose permet la production d’ATP, donc s’il y en a beaucoup dans les cellules bêta il y aura beaucoup d’ATP dans ces cellules, fermant leur canal potassique et donc les cellules bêta seront dépolarisées. Il existe un deuxième canal intéressant dans ces cellules qui est un canal calcique voltage-dépendant donc qui va s’ouvrir quand la cellule sera dépolarisée, ce qui est le cas ici. L’entrée de calcium servira ici à la sécrétion, un peu comme dans le neurone de la partie 1. Et nos cellules bêta vont sécréter l’insuline dans le plasma sanguin pour diminuer la glycémie. En plus de ce rôle de faire entrer le glucose dans le tissu adipeux et musculaire, l’insuline stimule sa mise en réserve dans ces cellules : dans le tissu adipeux le glucose subit la lipogenèse pour donner des triglycérides (un type de lipide). Dans le tissu musculaire le glucose subit la glycogénogenèse pour donner du glycogène, une molécule composée de l’association de plusieurs glucose simple. Dans le foie le glucose peut entrer sans l’aide de l’insuline mais l’insuline stimulera à la fois la lipogenèse et la glycogénogenèse. L’insuline peut aussi inhiber certaines voies : elle s’oppose ainsi à la néoglucogenèse dans le foie, c’est-à-dire à la production de glucose à partir de précurseurs non-glucidiques (en clair autre que des sucres). En effet on souhaite diminuer la glycémie, il ne faudrait donc pas produire du glucose qui pourrait être exporté du foie vers le sang. Enfin l’insuline s’oppose à la lipolyse, c’est-à-dire à l’hydrolyse des triglycérides, en clair à leur décomposition (l’inverse de la lipogenèse). Elle s’oppose aussi à la glycogénolyse, c’est-à-dire à la décomposition du glycogène en glucose simple (l’inverse de la glycogénogenèse).
Il faut donc retenir que l’insuline fait baisser la glycémie, pour cela elle stimule toutes les voies métaboliques qui permettent de consommer du glucose (sa mise en réserve par exemple) et inhibe toutes les voies métaboliques qui permettent la synthèse de glucose. Ces régulations portent sur le niveau d’activité des enzymes de ces différentes voies.
Entre les repas et à jeun
Donc l’insuline a fait son boulot, il reste peu de glucose dans le sang maintenant. Entre deux repas ou à jeun il ne faut pas pour autant que la glycémie soit nulle ou presque sinon c’est la mort, le cerveau est dépendant du glucose et l’ensemble des organes ont besoin de glucose pour produire de l’ATP qui sert de source d’énergie ensuite, comme nous avons déjà pu le voir à maintes reprises.
Si la glycémie reste plus ou moins constante autour d’une valeur de consigne cela suggère qu’il existe des mécanismes de régulation de la glycémie, qui l’empêche de trop évoluer, donc soit trop augmenter (l’insuline empêche cette augmentation comme nous venons de le voir) ou trop diminuer. Qui agit pour empêcher la glycémie de trop diminuer ? C’est simple, c’est une deuxième hormone clé appelée glucagon, cette deuxième hormone est donc dite hyperglycémiante car elle fait augmenter la glycémie quand celle-ci est trop basse. On dit qu’insuline et glucagon sont deux hormones antagonistes car ayant des rôles opposés.
Nous venons d’étudier l’insuline, cela va donc aller plus vite pour le glucagon.
Le glucagon est toujours produit par le pancréas quand la glycémie diminue, par les cellules alpha du pancréas cette fois-ci. J’ignore le mécanisme de sécrétion mais ce n’est pas important pour le cadre de ce cours.
Le glucagon fait exactement l’inverse de l’insuline : il inhibe toutes les voies que l’insuline stimulait, soit la lipogenèse et la glycogénogenèse. Il stimule toutes les voies que l’insuline inhibait, soit la néoglucogenèse hépatique (dans le foie), la lipolyse et la glycogénolyse. Le résultat est une augmentation de la glycémie. Notez que l’adrénaline a le même effet sur les muscles et le tissu adipeux. Ce qui est à mettre en lien avec le fait que le corps, en alerte, a besoin de glucose pour produire de l’énergie et réagir rapidement.
Seul le foie peut relarguer du glucose dans le sang pour faire augmenter la glycémie, suite à l’action du glucagon sur des récepteurs des cellules du foie.
Ainsi lors d’un jeûne prolongé la glycémie est maintenue plus ou moins constante, c’est le même phénomène qui se passe pendant plusieurs semaines sans manger. Jusqu’à ce que les réserves de glucose (glycogène) s’épuisent ou qu’il ne soit plus possible de former du glucose par néoglucogenèse à partir de précurseurs non-glucidiques (qui s’épuisent aussi à force, comme les graisses ou les protéines). Lorsque des protéines importantes seront utilisées pour faire du glucose, cela entraînera la mort.
Mais alors si le cyanure empêchait l’absorption intestinale du glucose comme nous l’avions supposé, ces mécanismes se mettraient en place et il ne devrait pas y avoir d’hypoglycémie ou alors cela serait négligeable. Cela n’entraînerait de toute façon pas la mort en quelques minutes comme on peut l’observer après l’ingestion du poison, puisque nous venons de voir que mourir de faim prend plusieurs semaines et selon notre hypothèse l’action du cyanure mimerait une mort de faim en privant l’organisme de son glucose. C’est donc que notre hypothèse était sûrement fausse.
Le glucose : molécule permettant la formation d'énergie sous forme d'ATP
Si le glucose ne vient pas à manquer lors de l’intoxication au cyanure, qu’est-ce qui provoque la mort ?
Pour le savoir regardons comment, à partir de glucose, les cellules produisent de l’énergie sous forme d’ATP.
Il existe chez tous les organismes vivants ou presque, une voie commune d’assimilation du glucose, qui débouche sur la formation d’ATP. On appelle improprement cette voie la glycolyse mais elle devrait rigoureusement être appelée voie d’Embden-Meyerhof-Parnas (ci-après abrégée EMP). En effet il existe plusieurs voies permettant de former de l’ATP à partir du glucose (3 voies) mais nous n’étudierons dans le cadre de ce cours que la voie EMP. Parler de glycolyse n’est donc pas correct puisqu’il y en a plusieurs, littéralement le terme signifie "lyse du glucose", c’est-à-dire sa dégradation par les cellules pour former de l’ATP.
Comment le glucose arrive aux cellules de l’ensemble de l’organisme ? Tout ce que nous mangeons va pouvoir potentiellement contenir du glucose, le pain contient de l’amidon (forme de réserve du glucose chez les plantes), les cellules animales en contiennent aussi, leurs muscles contiennent du glycogène (forme de réserve du glucose chez les animaux, voir avant), les champignons, tout quoi. Sauf l’eau, enfin si c’est de l’eau sucrée il y en aura.
Durant la digestion le corps va fabriquer des molécules de glucose qui seront absorbées au niveau intestinal comme nous l’avons vu avant. Notez qu’un carré de sucre de table ce n’est pas du glucose mais du saccharose, c’est une molécule formée par l’association d’un glucose et d’un fructose. Lors de la digestion, une enzyme nommée invertase découpe le saccharose pour donc donner du glucose et du fructose. Le fructose ne sera pas assimilé comme le glucose mais permettra finalement la formation d’ATP, dans une voie légèrement différente de celle qu’on va étudier. Cela est pareil pour d’autres sucres comme le galactose, quelques différences existent mais la voie EMP principale va toujours nous servir.
La voie EMP
Après son absorption intestinale le glucose du sang peut être rendu disponible pour toutes les cellules de l’organisme. Dans ces cellules le glucose commencera par être transformé dans le cytoplasme. La voie EMP prend place dans le cytoplasme des cellules.
Pour chaque réaction des protéines spéciales sont chargées de transformer une molécule en une autre, elles le font en accélérant ces réactions chimiques (on dit qu’elles catalysent les réactions), sans elles les réactions seraient très très lentes, digérer un petit-déjeuner pourrait par exemple prendre jusqu’à 50 ans ! Faut pas être pressé hein.
Ces protéines spéciales sont appelées enzymes. On retrouvera souvent le suffixe -ase pour les identifier. Finalement une seule molécule de glucose donnera 2 molécules d’ATP après toutes ces réactions.
Le bilan final de la voie EMP est alors le suivant : 1 glucose + 2 NAD+ + 2 ADP + 2 Pi = 2 pyruvate + 2 NADH,H+ + 2 ATP + 2 H2O. La voie EMP permet alors de produire, à partir d’un seul glucose, 2 ATP et 2 pyruvate.
Nous voyons alors que le glucose sert bien à produire de l’énergie sous forme d’ATP. Mais consommer un glucose pour produire 2 ATP est un rendement très faible, et 2 ATP ne suffisent pas pour alimenter en énergie les cellules consommatrices de beaucoup d’énergie comme les cellules musculaires ou les neurones. C’est donc que ce n’est pas fini et que le pyruvate produit (les deux pyruvates) vont poursuivre leur dégradation pour fournir encore plus d’ATP. C’est en effet le cas et ce que nous allons voir maintenant.
Le métabolisme aérobie fait appel au cycle de Krebs
Derrière ce titre se cache une réalité : lorsque du dioxygène est présent en quantité suffisante, c’est ce qu’on appelle être en conditions aérobies, le pyruvate produit peut passer du cytoplasme vers la mitochondrie pour intégrer une deuxième voie qui est le cycle de Krebs.
Le transfert du pyruvate vers l’intérieur de la mitochondrie
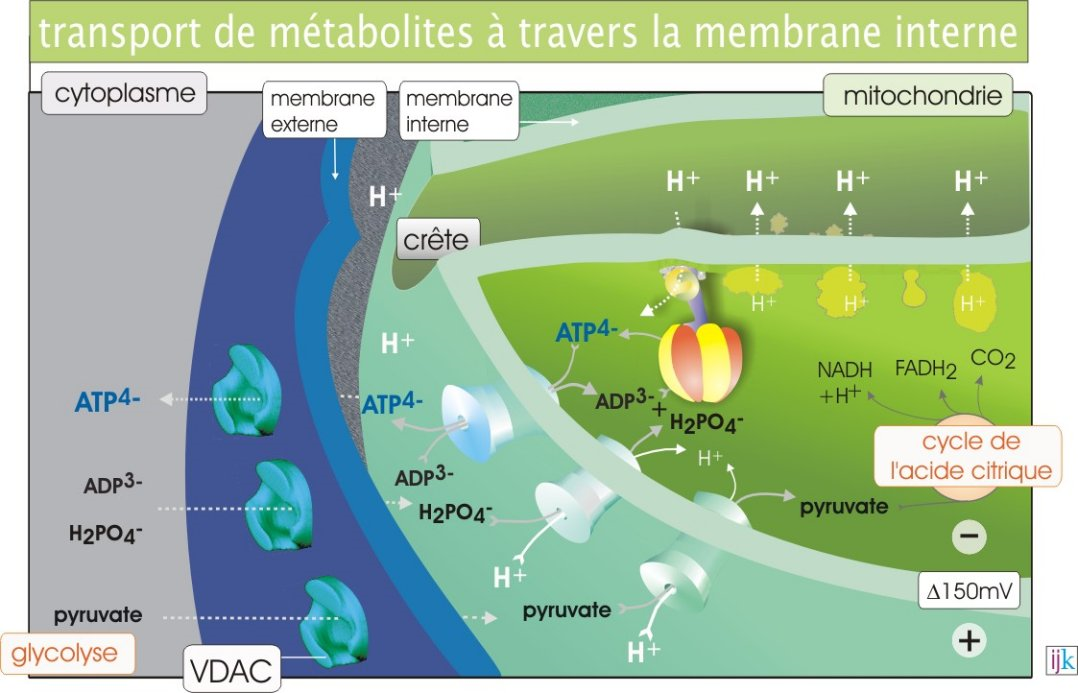
L’intérieur de la mitochondrie c’est ce qu’on appelle la matrice mitochondriale. La mitochondrie est un organite des cellules eucaryotes possédant une double membrane, c’est-à-dire une enveloppe. Entre ces deux membranes on distingue l’espace intermembranaire.
Le pyruvate passe sans problème la membrane externe mitochondriale, il se situe alors maintenant dans cet espace intermembranaire. Mais pour rejoindre la matrice mitochondriale, lieu du cycle de Krebs, le pyruvate doit franchir la membrane interne mitochondriale, qui est assez imperméable à pas mal de molécules et aux protons H+ (cela aura son importance plus tard dans ce cours). Cette membrane interne possède des invaginations et forme ce qu’on appelle des crêtes.
Pour passer le pyruvate va utiliser un transporteur appelé pyruvate translocase qui est en fait un symport H+/pyruvate. Rappelez-vous, un symport transfert deux molécules dans le même sens, ici les protons et le pyruvate seront donc transférés tous les deux vers la matrice mitochondriale. Ce système est ingénieux car au pH physiologique (environ 7) le groupement carboxyle COOH du pyruvate est chargé négativement sous forme COO-, le passage du pyruvate vers la matrice mitochondriale a donc tendance à apporter des charges négatives. Pour compenser cela à chaque fois qu’un pyruvate passe, la pyruvate translocase apporte une charge positive d’un proton H+.
L’image ci-dessous fournit un bon résumé et présente des choses que nous allons voir ensuite dans ce cours :
La décarboxylation oxydative du pyruvate forme l’Acétyl-coA
Une fois dans la matrice mitochondriale le pyruvate est pris en charge par un complexe enzymatique très complexe appelé pyruvate déshydrogénase. Le pyruvate est transformé en une molécule appelée Acétyl-coenzymeA (abrégée ci-après AcétylCoA).
Au cours de cette réaction il y a décarboxylation oxydative du pyruvate, c’est-à-dire que le pyruvate est à la fois oxydé et qu’il perd un groupement COO- et donc un atome de carbone (décarboxylation). Le pyruvate étant une molécule à 3 carbones alors on obtiendra une molécule à 2 carbones, mais pas exactement. L’acétyl-CoA ne possède pas uniquement 2 carbones mais sans prendre en compte la partie "coenzyme A" de la molécule alors on obtient effectivement 2 atomes de carbone.
Comme la réaction est une oxydation alors il y a nécessairement réduction d’une autre molécule, ici il s’agit encore d’une réduction du NAD+ en NADH,H+. Rappelons que la réaction dégage également une molécule de CO2 issue de la décarboxylation du pyruvate. Enfin la réaction consomme une molécule de coenzyme A.
Le bilan de cette seule réaction est donc : 1 pyruvate + NAD+ + CoenzymeA = 1 acétyl-coA + NADH,H+ + CO2. Soit : 2 pyruvate + 2 NAD+ + 2 CoenzymeA = 2 acétyl-coA + 2 NADH,H+ + 2CO2
Le cycle de Krebs produit des molécules de CO2, déchets de la respiration cellulaire
Une fois l’acétyl-coA produit ce n’est pas terminé, rappelons que nous n’avons toujours pas nos précieuses molécules d’ATP.
L’acétyl-coA va intégrer une deuxième voie qui est celle du cycle de Krebs, aussi appelé cycle de l’acide citrique ou cycle des acides tricarboxyliques. Cycle tant redouté par les étudiants.  À l’issue de ce cycle on produira ce que l’on appelle du pouvoir réducteur, utile pour la suite. Ce pouvoir réducteur est représenté par les molécules de NADH et FADH2.
À l’issue de ce cycle on produira ce que l’on appelle du pouvoir réducteur, utile pour la suite. Ce pouvoir réducteur est représenté par les molécules de NADH et FADH2.
Le bilan final de tout le cycle de Krebs, depuis la molécule d’acétyl-coA, est donc : 1 acétyl-coA + 2 H2O + 3 NAD+ + 1 FAD + 1 (GDP ou ADP) = 2 CO2 + 3 NADH,H+ + 1 FADH2 + 1 (GTP ou ATP) + 1 Coenzyme-A. Soit depuis nos 2 acétyl-coA (car rappelons qu’il y en a deux suite à la voie EMP, car il y avait 2 pyruvate) : 2 acétyl-coA + 4 H2O + 6 NAD+ + 2 FAD + 2 (GDP ou ADP) = 4 CO2 + 6 NADH,H+ + 2 FADH2 + 2 (GTP ou ATP) + 2 Coenzyme-A
Bon c’est bien beau tout ça, mais à part produire 2 GTP ou 2 ATP on n’a pas fait grand chose, car c’est encore largement insuffisant pour assurer l’alimentation des cellules nerveuses ou cardiaques par exemple !
Vous voyez qu’on a produit du pouvoir réducteur, c’est-à-dire des molécules qui ont été réduites au cours du cycle, il s’agit du NADH,H+ et du FADH2. Ces molécules vont se réoxyder pour être à nouveau disponibles lors de prochains cycles de Krebs, car si elles restaient réduites on ne pourrait plus les réutiliser, comme ces molécules sont limitantes dans une cellule alors elles peuvent vite manquer, il faut alors les réoxyder pour qu’elles soient réutilisables et qu’elles puissent être réduites lors de prochains cycles.
Ces molécules vont se réoxyder en cédant leurs électrons à travers ce qu’on appelle la chaîne respiratoire mitochondriale.
Il s’agit d’une suite de molécules disposées sur la membrane interne mitochondriale. Ces molécules vont tour à tour se réduire, d’où le nom de chaîne. Le NADH,H+ produit au cours du cycle de Krebs va se réoxyder en NAD+ et céder ses électrons à la première molécule de cette chaîne, qui va donc accepter ces électrons et se réduire. À son tour cette molécule réduite va se réoxyder pour pouvoir accepter de nouveaux électrons d’autres NADH,H+ ultérieurement. La molécule suivante se réduira alors etc. de proche en proche. On dit que le NADH,H+ est le donneur primaire d’électrons car dans la chaîne c’est lui le premier qui s’est oxydé et a cédé ses électrons.
Pour imager imaginez une chaîne de personnes sur un chantier. La première personne porte un gros sac de ciment, pour aller plus vite elle le passe à la personne à côté d’elle, cette deuxième personne va passer le sac à la troisième personne et ainsi de suite jusqu’à la dernière personne. Le sac de ciment serait un électron, chaque fois qu’une personne reçoit le sac elle se réduit, quand elle le passe à la personne à côté d’elle, elle s’oxyde et réduit la personne à côté d’elle. Le donneur primaire d’électron est la première personne qui donne le sac, l’accepteur final d’électron est la dernière personne à recevoir le sac et donc à se réduire. Dans la mitochondrie, l’accepteur final d’électron est le dioxygène.
Nous allons donc étudier cette chaîne respiratoire mitochondriale, c’est la fin et nous touchons à notre but : produire beaucoup d’ATP !
La chaîne respiratoire mitochondriale ou chaîne de transporteurs d’électrons
Notion de potentiel redox et transferts d’électrons
Pour comprendre ce qui va suivre (et même la partie 3 de ce cours) il est nécessaire d’aborder la notion de potentiel redox.
Le potentiel redox est une grandeur qui permet de prédire le sens de déplacement spontané des électrons entre deux espèces chimiques. Chaque couple redox (oxydant/réducteur) dispose d’un potentiel redox. Par exemple le couple NAD+/NADH,H+ a un potentiel redox de -0,32V.
Le transfert d’électrons entre deux espèces chimiques se fait spontanément, c’est-à-dire sans apport d’énergie extérieure, lorsque le potentiel redox du donneur d’électrons est inférieur au potentiel redox de l’accepteur (receveur) d’électrons. Nous allons voir que dans le cadre de la chaîne de transporteurs d’électrons mitochondriale, les transferts sont toujours spontanés car ils se font vers les potentiel redox croissants. Ce qui suppose que, comme NADH,H+ est le donneur primaire d’électrons dans la chaîne, alors tous les autres potentiel redox des accepteurs d’électrons seront forcément supérieurs à -0,32V.
La chaîne de transporteurs d’électrons
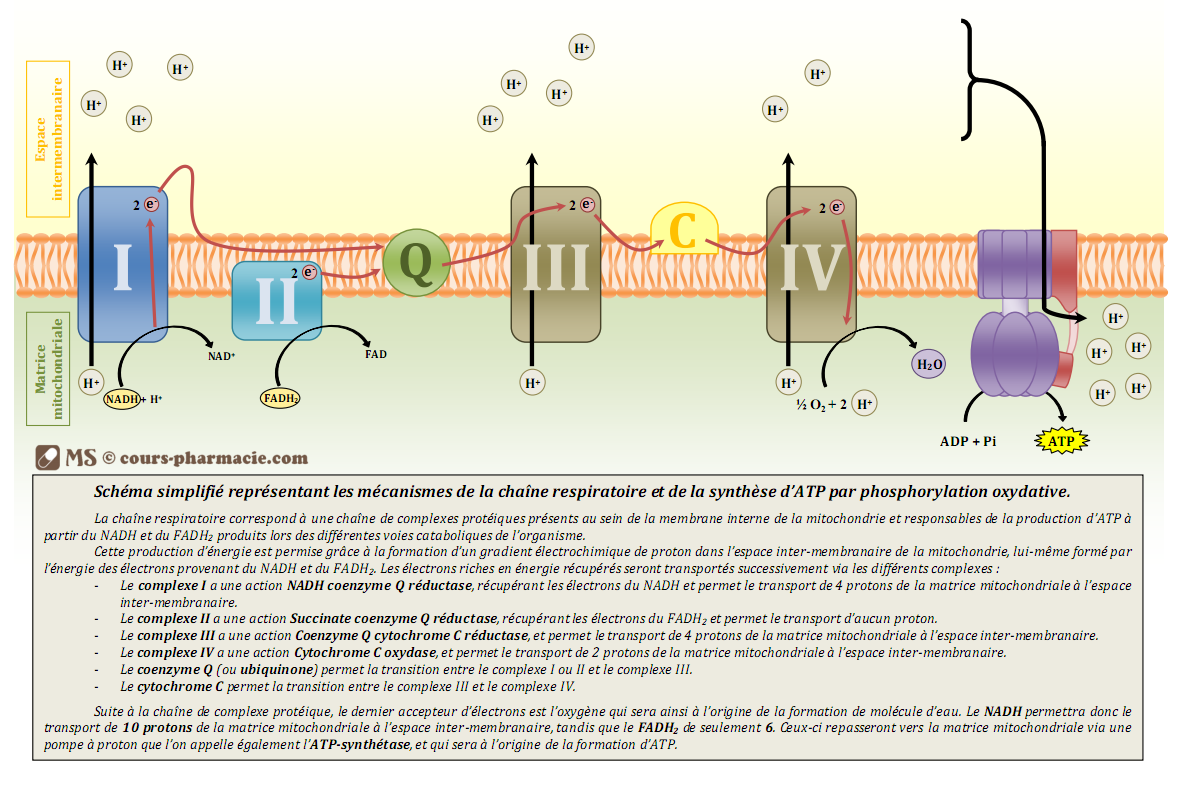
On dénombre 4 complexes dans cette chaîne et 5 si on prend en compte l’ATP synthase (voir après).
Le premier complexe enzymatique est appelé NADH déshydrogénase car il permet l’oxydation du NADH,H+. Il est aussi appelé NADH coenzyme Q réductase dans le sens ou il réduit le coenzyme Q, la molécule suivante de la chaîne.
La réaction d’oxydation du NADH,H+ en NAD+ est la suivante :
Le NADH,H+ permet donc, en s’oxydant en NAD+, de céder 2 électrons à la coenzyme Q (aussi appelée ubiquinone).
L’ubiquinone se réduit donc en acceptant ces électrons. Le transfert d’électrons vers l’ubiquinone est spontané car le potentiel redox du couple coenzyme Q10 réduit/coenzyme Q10 oxydé est supérieur à celui du couple NADH,H+/NAD+, il vaut +0,06V. Comme ce transfert d’électrons est spontané, cela fournit de l’énergie qui permet le pompage de 4 protons H+ de la matrice mitochondriale vers l’espace intermembranaire.
Le complexe 2 de la chaîne respiratoire mitochondriale est appelé succinate déshydrogénase ou encore succinate coenzyme Q réductase dans le sens où il réduit le coenzyme Q, la molécule suivante de la chaîne. En fait les complexes 1 et 2 cèdent tous les deux leurs électrons vers l’ubiquinone, il ne faut pas penser que le complexe 1 cède ses électrons au complexe 2.
Succinate déshydrogénase, cela ne vous rappelle rien ? Eh oui, c’était une des enzymes du cycle de Krebs, catalysant l’oxydation du succinate en fumarate. En fait le complexe 2 contient la succinate déshydrogénase mais ce n’est pas seulement la succinate déshydrogénase, un complexe enzymatique contient plusieurs autres choses : des centres fer etc. La succinate déshydrogénase qui oxyde le succinate en fumarate durant le cycle de Krebs fait donc partie du complexe 2 et se situe donc sur la membrane interne mitochondriale, réagissant avec le succinate de la matrice mitochondriale. En fait lorsque le succinate est oxydé en fumarate, les électrons sont dans un premier temps récupérés par le FAD qui se réduit en FADH2 (ce que nous avons vu dans le cycle de Krebs). Ensuite seulement le FADH2 se réoxyde en FAD pour pouvoir être réduit ultérieurement lors de nouveaux cycles de Krebs, un peu comme pour le NADH,H+. Les électrons cédés par le FADH2 qui se réoxyde en FAD vont être captés par l’ubiquinone, qui va se réduire.
La réaction d’oxydation du FADH2 en FAD est la suivante :
Même si le transfert est encore spontané (potentiel redox de -0,20V pour le couple FADH2/FAD), on n’observe pas de transfert de protons H+ vers l’espace intermembranaire.
Le complexe 3 de la chaîne est appelé coenzyme Q cytochrome c réductase car il permet l’oxydation du coenzyme Q et la réduction du cytochrome c, la molécule succédant le coenzyme Q dans la chaîne respiratoire.
Ainsi le coenzyme Q qui avait été réduit en acceptant les électrons du FADH2 et NADH,H+, va s’oxyder en cédant ses électrons au cytochrome c selon la réaction :
Le transfert est bien spontané, le potentiel redox du couple coenzyme Q10 réduit/coenzyme Q10 oxydé étant de +0,06V et celui du couple cytochrome c réduit/cytochrome c oxydé vaut +0,22V.
Le transfert permet encore une fois de transférer 4 protons H+ depuis la matrice mitochondriale vers l’espace intermembranaire.
Le dernier complexe est appelé cytochrome c oxydase car il permet l’oxydation du cytochrome c réduit par le complexe 3. Il permet donc la réduction de l’accepteur final d’électrons qui est le dioxygène qui se réduira en molécule d’eau.
Le transfert est spontané car le potentiel redox du couple H2O/O2 est très élevé, parmi les plus élevés rencontrés, il vaut +0,82V ! Ce transfert permet de pomper 2 protons H+ (et non plus 4) de la matrice mitochondriale vers l’espace intermembranaire.
Il y a réduction du dioxygène selon la réaction suivante :
Pour résumé voici une très belle image montrant la chaîne respiratoire, cela permettra de mieux visualiser les choses pour vous :
La synthèse d’ATP nécessite de l’énergie
Ainsi nous extrapoler et dire que pour faire de l’énergie il faut de l’énergie, c’est con la vie parfois.  En effet la réduction d’une seule molécule de dioxygène en fin de chaîne respiratoire nécessite donc 4 protons H+ présents dans la matrice mitochondriale ainsi que 4 électrons, qui viennent vers le dioxygène depuis le cytochrome c qui s’oxyde donc. Une partie des protons H+ de la matrice est donc pompée vers l’espace intermembranaire au cours des transferts successifs des électrons dans la chaîne mais pas tous, une partie reste disponible dans la matrice pour réduire le dioxygène en eau.
En effet la réduction d’une seule molécule de dioxygène en fin de chaîne respiratoire nécessite donc 4 protons H+ présents dans la matrice mitochondriale ainsi que 4 électrons, qui viennent vers le dioxygène depuis le cytochrome c qui s’oxyde donc. Une partie des protons H+ de la matrice est donc pompée vers l’espace intermembranaire au cours des transferts successifs des électrons dans la chaîne mais pas tous, une partie reste disponible dans la matrice pour réduire le dioxygène en eau.
Mais pomper ces protons vers l’espace intermembranaire, à force cela ne risque-t-il pas de vider la matrice mitochondriale de ses protons et donc de ne plus permettre la réduction du dioxygène en eau ?
Non ! Et pour une bonne raison.
Il y aura toujours des protons disponibles dans la matrice, seulement il y en aura toujours plus dans l’espace intermembranaire que dans la matrice. Comme la concentration des protons en solution renvoie au pH alors l’espace intermembranaire sera plus acide que la matrice mitochondriale. Comme les protons sont chargés positivement alors l’espace intermembranaire sera chargé positivement par rapport à la matrice mitochondriale, d’où le potentiel membranaire mitochondrial observé sur l’image que nous vous avions donné : -150mV !
Comme la membrane interne mitochondriale est imperméable aux protons alors il n’y a pas de fuite et ces protons s’accumulent bien dans l’espace intermembranaire au cours du fonctionnement de la chaîne respiratoire. Ils sont alors plus concentrés dans cet espace et peuvent donc être transportés passivement vers la matrice mitochondriale pour y retourner et donc qu’il y ait toujours des protons disponibles dans la matrice : il s’agit d’un transport passif par diffusion facilitée qui se fait à travers un complexe spécial appelé l’ATP synthase, souvent considéré comme étant le 5ème complexe de la chaîne respiratoire. De plus le fait que la matrice mitochondriale soit chargé négativement par rapport à l’espace intermembranaire facilite le transport des protons vers la matrice car ils sont chargés positivement, deux charges de signes opposés s’attirant.
Si la membrane interne mitochondriale devenait perméable aux protons pour une raison ou pour une autre, il y aurait dissipation de ce gradient de protons et cela poserait problème. En effet maintenir une plus grande concentration de protons dans l’espace intermembranaire va être la clé de la synthèse de l’ATP (ouf, enfin !  ).
).
En diffusant passivement vers la matrice, les protons passant à travers l’ATP synthase vont permettre en quelque sorte d’activer l’ATP synthase par des changements de conformation. L’ATP synthase a pour molécules cibles du Pi et de l’ADP, en changeant de conformation elle va permettre la synthèse d’ATP à partir de la condensation d’ADP et de Pi, l’ATP sera ensuite relâche dans la matrice mitochondriale.
Ainsi la synthèse d’ATP se fait en utilisant l’énergie dégagée par le retour des protons vers la matrice mitochondriale, on dit que la présence d’une forte concentration de protons en H+ dans l’espace intermembranaire par rapport à la matrice mitochondriale constitue une force appelée force proton-motrice : cette théorie expliquant la synthèse d’ATP est maintenant largement acceptée dans le monde scientifique et avait été postulée par Mitchell sous le nom de la théorie chimio-osmotique de Mitchell.
Il y a alors un couplage entre des réactions nécessitant de l’énergie, dites réactions endergoniques (ici faire de l’ATP coûte de l’énergie) et les réactions libérant de l’énergie, dites réactions exergoniques (ici le transfert des électrons dans la chaîne respiratoire, car ils sont spontanés en suivant les potentiels redox croissants). Les réactions exergoniques permettent la réalisation des réactions endergoniques.
On parle de phosphorylation oxydative de l’ADP en ATP : car il est phosphorylé en présence de dioxygène.
Les différents transports au niveau de la membrane interne mitochondriale
Si vous revenez sur l’image que nous vous avions donné, montrant le symport pyruvate/H+, on y voyait également d’autres transporteurs au niveau de la membrane interne mitochondriale, il est temps d’y revenir.
Sur cette image H2PO4- est l’équivalent du Pi, il existe donc également un symport Pi/H+ au niveau de la membrane interne mitochondriale, assurant en permanence le transfert de Pi vers la matrice mitochondriale, utilisé pour la synthèse d’ATP. Comme le Pi est chargé négativement il aura du mal à aller vers la matrice, elle aussi, chargée négativement. C’est la raison d’être de ce symport qui va utiliser l’énergie contenue dans le gradient électrochimique des protons qui, eux, diffusent selon leur gradient électrochimique vers la matrice pour permettre le transport dans le même sens des Pi : c’est bien un transport actif secondaire, rappelez-vous. Il en est de même pour la pyruvate translocase, ce que nous avions oublié de vous signaler plus tôt dans ce cours.
Par ailleurs une fois l’ATP produit celui-ci doit sortir de la matrice mitochondriale pour rejoindre l’espace intermembranaire et le reste de la cellule. Pour cela un transporteur appelé ATP translocase fonctionne en échangeant un ADP contre un ATP. L’ADP rejoint la matrice et l’ATP sort, les deux molécules sont transportées dans le sens inverse, ce n’est plus ce qu’on appelle un symport mais un antiport.
Le rendement final d’ATP : depuis la voie EMP jusqu’à la chaîne respiratoire est considérable
Finissons en regardant combien d’ATP on a pu produire à partir d’une seule molécule de glucose.
Avant cela il faut savoir qu’une molécule de NADH,H+ permet, en se réoxydant et en cédant ses électrons, la synthèse de 3 ATP (2,5 en réalité) alors qu’une molécule de FADH2 permet, en se réoxydant et en cédant ses électrons, la synthèse de 2 ATP (1,5 en réalité), ce plus faible rendement pour FADH2 est sans doute dû au fait que le complexe 2 ne permet pas de pomper les protons vers l’espace intermembranaire (voir avant).
Durant la voie EMP
On produit 2 ATP et 2 NADH,H+. Ce NADH,H+ cytoplasmique transmet ses électrons jusqu’à la membrane interne mitochondriale, cela permettra ainsi sa réoxydation dans le cytoplasme pour que la voie EMP puisse se poursuivre ultérieurement. Les NADH,H+ de la matrice mitochondriale, eux, se réoxydent comme nous l’avons vu avant.
Ce transport des électrons depuis le NADH,H+ cytosolique jusqu’à la membrane interne mitochondriale peut se faire via deux systèmes : celui appelé la navette malate-aspartate ou celui de la navette du glycérol-3-phosphatase (à ne pas confondre avec le glycéraldéhyde-3-phosphate de la voie EMP). Selon la navette utilisée 2 ou 3 ATP seront produits par NADH,H+ cytosolique réoxydé. La navette malate-aspartate permettra la production de 3 ATP alors que celle du glycérol-3-phosphate permettra la production de 2 ATP. Cela se répercutera donc sur le rendement final.
Comme 1 NADH,H+ permet la production de 3 ATP, le rendement provisoire pendant la voie EMP est de 8 ATP si on considère la navette malate-aspartate ou 6 ATP si on considère la navette du glycérol-3-phosphate. La navette du glycérol-3-phosphate est donc énergétiquement moins intéressante pour la cellule mais est en revanche plus rapide pour elle, ce qui est utile pour des organes devant consommer de l’énergie rapidement comme les muscles ou encore le cerveau.
Durant la décarboxylation oxydative du pyruvate en acétyl-coA
On produit 2 NADH,H+ qui permettront la formation de 6 ATP.
Durant le cycle de Krebs + chaîne respiratoire
On produit 6 NADH,H+, 2 ATP ou 2 GTP et 2 FADH2. On a alors production de 24 ATP grâce à la chaîne respiratoire ensuite !
Depuis le début
On produit ainsi, depuis la voie EMP jusqu’à la chaîne respiratoire, un total de 36 ou 38 ATP selon la navette considérée ! C’est satisfaisant pour assurer la fonction des cellules consommatrices d’énergie !
Revenons sur notre cyanure
Et donc le cyanure dans tout cela ?
Bonne question, nous y voilà enfin après ces voies interminables !
Nous avions rejeté notre hypothèse qui disait que c’est le manque de glucose qui tuait. Alors nous avions dit que c’est un autre mécanisme qui est en cause dans la mort par l’intoxication au cyanure, sans le trouver. Avant ça il était plus que nécessaire de comprendre comment la cellule produit son énergie à partir de glucose et vous allez comprendre pourquoi maintenant.
Si ce n’est pas le glucose qui manque c’est autre chose. Est-ce le dioxygène ? Non car on respire, pourtant on meurt quand même. Les deux sont là mais on meurt, pourquoi ?
Le poison doit alors sans doute bloquer quelque chose, une voie primordiale dans la synthèse d’ATP puisque sans ATP c’est la mort. Mais que bloque-t-il, à quel niveau ? La voie EMP ? La décarboxylation oxydative du pyruvate ? Le cycle de Krebs ? La chaîne respiratoire mitochondriale ? Une combinaison de tout cela ? Absolument tout ?
Pas facile de le savoir comme ça. Mais nous vous proposons quelques expériences, inventées par moi. 
Expérience 1 : contrôle positif
On cherche à déterminer le mode d’action du cyanure sur la synthèse d’ATP cellulaire.
Sur une culture cellulaire eucaryote placée dans des conditions reproduisant celles in-vivo (concentrations ioniques, températures, pression osmotique, glucose présent, dioxygène…) on dose l’ATP produit à différents temps notés t.
À t=5min : le taux d’ATP est constant.
À t=10min : injection d’eau physiologique, le taux d’ATP reste constant.
Expérience 2 : blocage de la voie EMP
À t=5min : le taux d’ATP est constant.
À t=10min : injection d’un puissant inhibiteur de la pyruvate kinase. On observe que le taux d’ATP produit diminue considérablement.
À t=15min : injection de taux élevés de pyruvate. Les taux d’ATP produits réaugmentent peu à peu.
Lorsque la même expérience est menée en utilisant du cyanure à la place d’un inhibiteur de la pyruvate kinase, les résultats observés sont différents : la production d’ATP n’est pas restaurée.
Expérience 3 : blocage de la décarboxylation oxydative du pyruvate
À t=5min : le taux d’ATP est constant.
À t=10min : injection d’un puissant inhibiteur de la pyruvate déshydrogénase. On observe que le taux d’ATP produit diminue considérablement.
À t=15min : injection de taux élevés d’acétyl-coA. Les taux d’ATP produits réaugmentent peu à peu.
Lorsque la même expérience est menée en utilisant du cyanure à la place d’un inhibiteur de la pyruvate déshydrogénase, les résultats observés sont différents : la production d’ATP n’est pas restaurée.
Expérience 4 : blocage au début du cycle de Krebs (empêchant toute formation de pouvoir réducteur)
À t=5min : le taux d’ATP est constant.
À t=10min : injection d’un puissant inhibiteur de l’aconitase. On observe que le taux d’ATP produit diminue considérablement.
À t=15min : injection de taux élevés de pouvoir réducteur. Les taux d’ATP produits réaugmentent peu à peu.
Lorsque la même expérience est menée en utilisant du cyanure à la place d’un inhibiteur de l’aconitase, les résultats observés sont différents : la production d’ATP n’est pas restaurée.
Interprétation
L’expérience 1 est simplement un test de contrôle positif, il montre ce qu’il se passe en temps normal avec du glucose disponible dans le milieu, donc il y a production d’ATP. Il permet également de savoir que ce n’est pas la technique employée d’injection des produits dans le milieu qui est responsable de la modification des taux d’ATP dans les autres expériences, car en injectant de l’eau rien ne se passe. Ce sont donc les drogues qui agissent vraiment sur les taux d’ATP produits ensuite.
L’expérience 2 montre une diminution d’ATP après injection d’un inhibiteur de la pyruvate kinase, dernière enzyme de la voie EMP produisant le pyruvate. En effet sans pyruvate on court-circuite les voies métaboliques et pas d’ATP produit finalement. Il y a restauration d’ATP quand on injecte directement dans le milieu le pyruvate, toujours en présence de l’inhibiteur, car cela permet de contourner la réaction catalysée par la pyruvate kinase. En présence de cyanure à la place de l’inhibiteur, l’apport de pyruvate ne change rien. C’est donc que le cyanure bloque en aval, c’est-à-dire après, la voie EMP !
L’expérience 3 montre une diminution d’ATP après injection d’un inhibiteur de la pyruvate déshydrogénase, enzyme transformant le pyruvate en acétyl-coA dans la matrice mitochondriale. C’est normal puisque c’est un composant essentiel pour le cycle de Krebs et donc la formation d’ATP finalement. On restaure l’ATP en injectant directement dans le milieu l’acétyl-coA, toujours en présence de l’inhibiteur, cela permet de contourner la réaction catalysée par la pyruvate déshydrogénase. En présence de cyanure à la place de l’inhibiteur, l’apport d’acétyl-coA ne change rien. C’est donc que le cyanure bloque après cette étape de décarboxylation oxydative.
L’expérience 4 montre une dminution d’ATP après injection d’un inhibiteur de l’aconitase, enzyme transformant le citrate en isocitrate. C’est normal puisqu’on bloque au tout début du cycle, ne permettant pas de produire le pouvoir réducteur NADH,H+ et FADH2, il s’ensuit une perte conséquente d’ATP. En injectant directement ce pouvoir réducteur dans le milieu, toujours en présence de l’inhibiteur, on restaure la production d’ATP. En présence de cyanure à la place de l’inhibiteur, l’apport de pouvoir réducteur ne change rien, le cyanure bloque toujours après cette étape.
Il ne peut pas bloquer plus tard dans le cycle de Krebs car on apporte le pouvoir réducteur directement et pas seulement la molécule permettant de contourner la réaction inhibée, c’est-à-dire l’isocitrate. Ainsi nous sommes certains que le blocage a lieu au niveau de la chaîne respiratoire, sur l’un des 5 complexes, ou même au niveau de l’ubquinone ou du cytochrome c. En réalité, le cyanure inhibe le complexe 4 de la chaîne respiratoire.
On comprend désormais mieux pourquoi le cyanure est rapidement mortel, même en présence de glucose et de dioxygène celui-ci ne peut être utilisé. Puisque le complexe 4 est inhibé alors il ne cède plus ses électrons au dioxygène, celui-ci ne se réduit plus en eau et s’accumule dans les cellules et le sang. Il donne ainsi quelques fois une teinte rose vif à la peau, témoignant de la non-utilisation du dioxygène par les cellules, malgré qu’il soit présent dans l’organisme. Si le complexe 4 ne cède plus ses électrons au dioxygène alors il reste réduit, il fait comme un embouteillage à tous les complexes qui le précèdent sur la chaîne !
En reprenant l’image du chantier avec la chaîne de personnes, imaginez que l’avant dernière personne de la file décide pour n’importe quelle raison de ne plus céder son sac de ciment à la dernière personne, représentant le dioxygène. Que se passerait-il ? Eh bien elle aurait ses deux mains occupées à porter le sac : cette personne ne pourrait plus accepter un autre sac.
Ainsi la personne derrière elle ne pourrait plus non plus donner son sac, même si elle le souhaite. À son tour elle aurait ses mains occupées et ne pourrait plus accepter de sac, de proche en proche jusqu’à la première personne qui ne pourrait pas non plus donner son sac à la deuxième. Dans la chaîne respiratoire la situation est identique, le cytochrome c n’est plus oxydé et reste réduit, il s’en suit par voie de conséquence que le complexe 3 reste réduit, l’ubiquinone également puis les complexes 1 et 2, en un mot : il y a arrêt du transport des électrons, même en présence de pouvoir réducteur car le NADH,H+ et FADH2 ne peuvent plus se réoxyder.
Cela perturbe le cycle de Krebs car ces molécules sont limitantes, à force il va s’arrêter au niveau de la réaction catalysée par l’isocitrate déshydrogénase, soit la première oxydation du cycle. Cet arrêt du transfert des électrons dans la chaîne ne permet donc plus de pomper des protons vers l’espace intermembranaire et le gradient électrochimique de proton disparaît puisqu’à force que les protons diffusent vers la matrice pour la synthèse d’ATP ils n’y retournent plus, il y a équilibre des concentrations des deux côtés de la membrane interne mitochondriale.
Il n’y a plus de possibilité pour l’ATP synthase de faire de l’ATP car les protons ne diffusent plus vers la matrice, il y a équilibre, la matrice a maintenant gagné des charges positives en nombre et les concentrations sont égales des deux côtés de la membrane. L’ATP est nécessaire à des fonctions cellulaires importantes comme la contraction musculaire, il en résulterait rapidement un blocage des muscles respiratoires et cardiaques par exemple. Le système nerveux ne fonctionnerait plus également. Cela concorde bien avec les symptômes observés en cas d’intoxication au cyanure (apnée, confusions, coma, gêne respiratoire puis mort…).
Pour revenir sur le début de ce chapitre, nous avions supposé que le cyanure tuait en empêchant l’absorption intestinale du glucose, on sait maintenant que la mort n’est pas due à ça mais sachez que nous n’avions pas tout faux quand même ! 
En effet il y a une contribution modeste du cyanure sur l’absorption intestinale du glucose ainsi que sur l’oxygénation des tissus, c’est l’objet de notre prochain chapitre.
Long chapitre n’est-ce pas ?
Vous comprenez maintenant mieux l’action du cyanure sur l’organisme.
Voici ce qu’il faut en retenir :
L’essentiel : le glucose est absorbé au niveau de l’intestin grêle et ainsi mis à disposition dans le sang pour toutes les cellules de l’organisme. Parallèlement le dioxygène inspiré atteint également le sang pour être utilisé par les cellules. Le glucose subit dans le cytoplasme des cellules la voie EMP et donne 2 pyruvate qui iront dans la matrice mitochondriale pour donner 2 acétyl-coA. Ces derniers subiront le cycle de Krebs où, chaque tour de cycle, permettra de rejeter 2 molécules de CO2, produire 3 NADH,H+, 1 ATP ou GTP et 1 FADH2. Ce pouvoir réducteur sous forme de NADH,H+ et FADH2 alimentera la chaîne respiratoire de la membrane interne mitochondriale via le transfert des électrons dont l’accepteur final, le dioxygène inspiré, se réduit en eau. Tant que le dioxygène est disponible le transfert continue et permet de pomper des protons depuis la matrice vers l’espace intermembranaire, créant un gradient électrochimique de protons, qui en retournant dans la matrice via l’ATP synthase, permettront la synthèse d’ATP par l’ATP synthase.