Dans cette partie, contrairement à la précédente, nous ne vous proposons pas un Q.C.M ni des questions courtes mais bien un exercice complet qui vous permettra de redécouvrir ce que vous venez de voir d’une façon différente.
Si vous avez du mal sur certaines questions essayez de ne pas retourner directement sur le cours. Faites-le si vous vous trouvez dans une réelle difficulté et ne regardez la correction qu’en cas de dernier recours. Nous pensons qu’il est plus intéressant pour vous de jouer le jeu. 
Exercice : des adaptations étranges !
Le dioxygène est une molécule importante pour de nombreuses formes de vie. Son utilisation par la chaine respiratoire mitochondriale permet de produire de l’ATP fournissant l’énergie nécessaire aux cellules. Le but de cet exercice est d’étudier 4 cas biologiques dans lesquels l’équipement moléculaire de la cellule est remarquablement adapté à une utilisation particulière du dioxygène : l’apnée, l’effet Warburg, l’effort intense et l’hibernation.
L’apnée
Au repos chez un sujet sain (situation qualifiée de normoxie), on donne les valeurs suivantes de pression partielle en dioxygène :
- 100 mmHg au niveau alvéolaire ;
- 100 mmHg en sortie des capillaires pulmonaires ;
- 40 mmHg en sortie des capillaires systémiques ;
- Environ 40 mmHg dans les muscles striés squelettiques.
Après 2 minutes d’apnée chez un même sujet (situation qualifiée d’hypoxie), on donne les valeurs suivantes de pression partielle en dioxygène :
- 50 mmHg au niveau alvéolaire ;
- 50 mmHg en sortie des capillaires pulmonaires ;
- 5 mmHg en sortie des capillaires systémiques ;
- Environ 5 mmHg dans les muscles striés squelettiques.
Question 1 : expliquer les modifications observées pour la pression partielle en dioxygène après 2 minutes d’apnée.
On souhaite désormais savoir si les cellules musculaires striées squelettiques pourront s’adapter à cette diminution de pression partielle en dioxygène après 2 minutes d’apnée. Pour cela on réalise les expériences présentées ci-après.
Expérience 1 :
La protéine HIF1- (Hypoxia Inducible Factor) est une protéine du cytoplasme de toutes les cellules. Dans des cellules cancéreuses on a comparé son expression protéique dans 3 conditions expérimentales différentes : sans ajout de (chlorure de cobalt) ©, 4h après ajout de à la concentration de 100 µM et 4h après ajout de à la concentration de 300 µM. Le chlorure de cobalt mime les effets d’une hypoxie. Les résultats de l’expérience sont présentés ci-après :
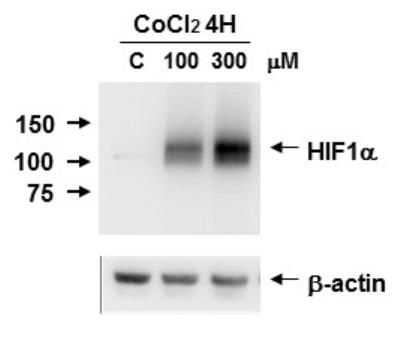
Informations utiles :
- Plus une bande est sombre plus la protéine est présente dans le cytoplasme des cellules ;
- Les nombres indiqués sur le côté gauche de la membrane (150, 100 et 75) indiquent le poids moléculaire de la protéine étudiée (unité kDa), ici le poids moléculaire de HIF1- est compris entre 100 et 150 kDa ;
- La -actine est une protéine de référence dont on sait qu’elle n’est pas affectée par le traitement expérimental (le chlorure de cobalt). Elle est retrouvée en même quantité dans les cellules et dans les trois conditions étudiées ici. Cela permet de s’assurer que les éventuelles différences observées pour la protéine d’intérêt (HIF1-) ne sont pas dues au fait qu’on aurait pris des quantités différentes de protéines totales entre les différentes conditions par exemple mais bien dues au chlorure de cobalt.
Question 2 : en se replaçant dans le contexte de cellules musculaires striées squelettiques, que peut-on potentiellement tirer de cette première expérience ?
Expérience 2 :
L’enzyme PDK1 (Pyruvate Déshydrogénase Kinase 1) est une enzyme capable d’inhiber la pyruvate déshydrogénase de la matrice mitochondriale. Une expérience d’immunoblot permet de révéler que PDK1 est présent en plus grande quantité dans les cellules lors d’une hypoxie.
Informations utiles :
- "Loading" peut être comparable à l’utilisation de la -actine pour l’expérience ;
- L’immunoblot est une technique légèrement différente du western blot de l’expérience 1. Le western blot utilise des anticorps dirigés spécifiquement contre la protéine à révéler, ce qui produit une bande si la protéine est présente dans la condition testée. Mais l’étape utilisant l’anticorps dirigé contre cette protéine succède à une étape d’électrophorèse qui permet de séparer les différentes protéines d’une cellule en fonction de leur poids moléculaire. La technique d’immunoblot, elle, n’utilise pas cette étape d’électrophorèse et donc toutes les protéines de la cellule sont au même niveau de la membrane.
Question 3 : quel est l’intérêt d’utiliser la technique d’immunoblot ici et non la technique de western blot comme pour la première expérience ?
Expérience 3 :
Selon le même article présenté en expérience 2, les chercheurs ont trouvé que la protéine HIF1- était capable d’activer la protéine PDK1 (résultats non présentés ici).
Question 4 : en se replaçant dans le contexte de cellules musculaires striées squelettiques, que peut-on potentiellement tirer des trois premières expériences ?
D’autres investigations ont montré qu’en situation d’hypoxie le pyruvate formé lors de la glycolyse ne pouvait plus pénétrer dans la matrice mitochondriale.
Question 5 : sur la base des trois expériences présentées ci-dessus, expliquer pourquoi le pyruvate cytoplasmique ne peut plus entrer dans la matrice mitochondriale (deux raisons attendues).
D’autres recherches ont alors souhaité connaître le destin du pyruvate puisque ce dernier ne pouvait plus être pris en charge par les mitochondries pour former de l’ATP lorsque la cellule était en situation d’hypoxie. Pour cela l’expérience suivante a été réalisée.
Expérience 4 :
Des chercheurs ont étudié l’effet de l’hypoxie sur l’expression protéique d’une enzyme appelée lactate déshydrogénase (abrégée LDH). Le paramètre mesuré est le pourcentage de libération de LDH dans le milieu extracellulaire par deux types cellulaires (cellules CACO-2 et hépatocytes) en normoxie et en hypoxie. Les résultats de l’expérience sont présentés ci-après :
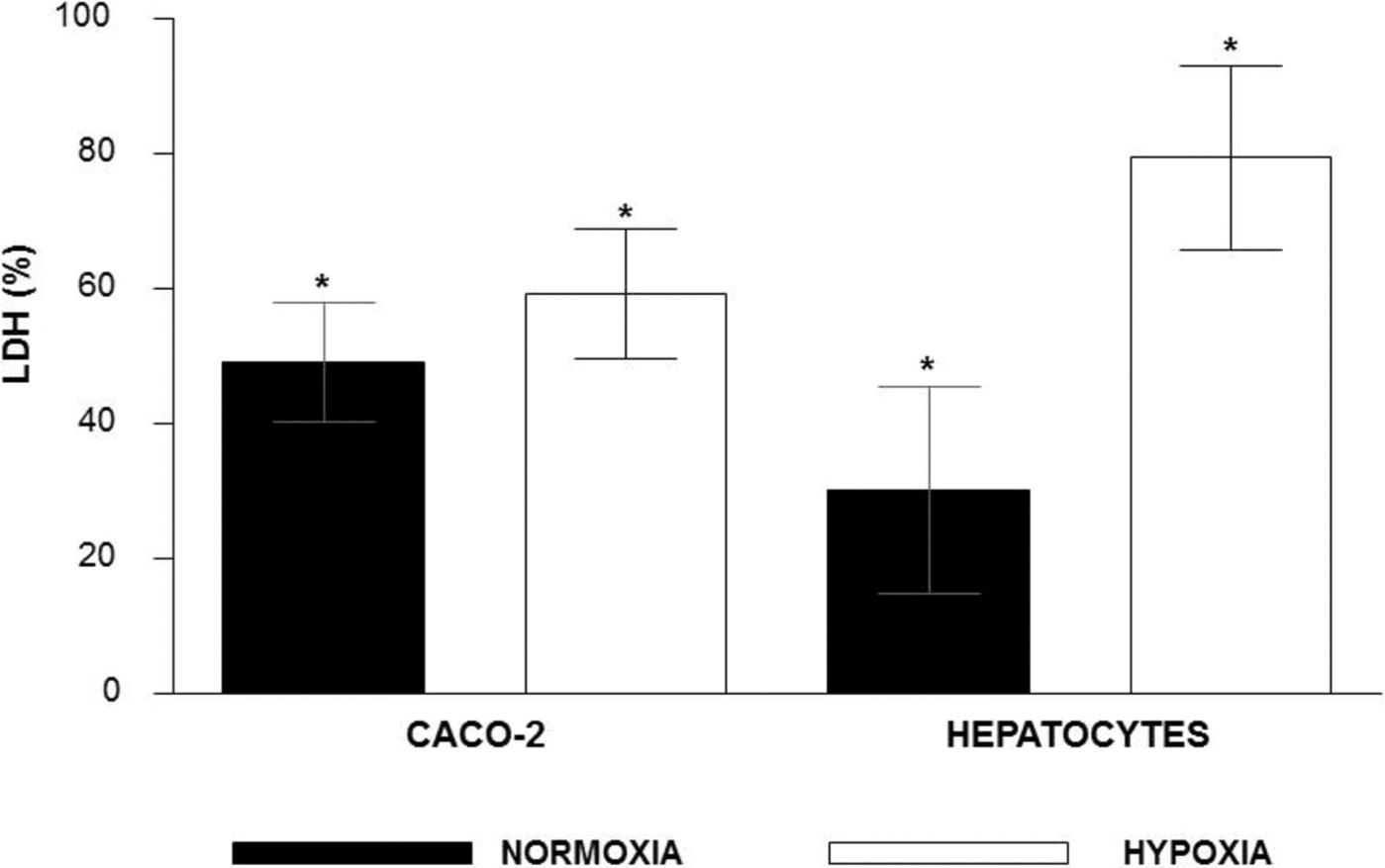
Information utile :
- La LDH permet la réaction réversible suivante dans le cytoplasme :
Question 6 : sur la base de cette expérience, comment la cellule fabrique-t-elle alors de l’ATP en situation d’hypoxie ?
Dans le cytoplasme des cellules musculaires striées squelettiques, il existe également une protéine de liaison du dioxygène comparable à l’hémoglobine, elle est appelée myoglobine et ne dispose que d’un seul site de liaison au dioxygène, contrairement à l’hémoglobine. Lorsque la myoglobine fixe du dioxygène elle est appelée oxymyoglobine. Il est possible de tracer les courbes de dissociation de l’oxyhémoglobine et de l’oxymyoglobine :
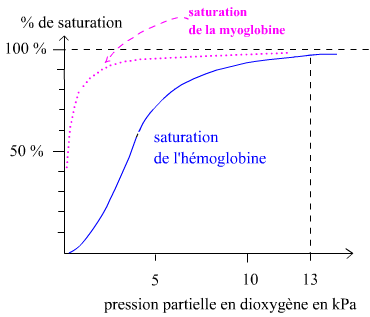
Information utile :
- Après 2 minutes d’apnée la pression partielle en dioxygène dans les cellules musculaires striées squelettiques est suffisamment abaissée pour provoquer une désaturation notable de l’oxymyoglobine.
Question 7 : expliquer pourquoi il est raisonnable de penser que le dioxygène libéré par la myoglobine, au bout de 2 minutes d’apnée, pourrait ne pas être consommé par la cellule musculaire. Dans ce cas quel est l’intérêt physiologique de cette désaturation à 2 minutes d’apnée ?
Question 8 : expliquer (1) la forme hyperbolique de la courbe de dissociation de l’oxymyoglobine et (2) le fait qu’à une pression partielle en dioxygène donnée la saturation de la myoglobine soit supérieure à celle de l’hémoglobine. Quel est l’intérêt physiologique du fait expliqué en (2) ?
L’effet Warburg
Des recherches plus approfondies ont par la suite révélé que certaines cellules cancéreuses possédaient une plus grande quantité de la protéine HIF1- par rapport à des cellules non cancéreuses. Ces cellules cancéreuses et non cancéreuses étaient placées en condition de normoxie.
Question 9 : quel pourrait être l’impact de cette différence sur le métabolisme énergétique de ces cellules cancéreuses par rapport aux cellules non cancéreuses ?
L’effort intense
L’apnée et l’effort intense provoquent au niveau de la cellule musculaire des changements métaboliques semblables mais les aspects moléculaires sont différents.
Lors des premières secondes d’un effort intense, une enzyme des cellules musculaires striées squelettiques, appelée la créatine kinase, réalise la réaction réversible suivante :
Question 10 : lors des premières secondes d’un effort intense, la réaction enzymatique ci-dessus sera-t-elle favorisée dans le sens gauche vers la droite ou dans le sens droite vers la gauche ? Expliquer.
L’enzyme permettant la réaction irréversible suivante de la glycolyse : est régulée de manière allostérique par l’ATP. Plus précisément l’ATP constitue un effecteur hétérotrope négatif.
Question 11 : justifier que lors des premières secondes d’un effort intense la vitesse de la glycolyse sera très accélérée.
Question 12 : la conséquence de l’accélération de la vitesse de la glycolyse est une diminution notable de la pression partielle en dioxygène des cellules musculaires et de la pression partielle en dioxygène des capillaires irriguant ces cellules musculaires. Expliquer.
Question 13 : justifier alors, que lors des premières secondes d’un effort intense, une situation d’hypoxie s’installe dans la cellule. En utilisant la réponse à la question 6, que se passera-t-il dans la cellule musculaire ?
L’hibernation
Les nouveaux-nés et les animaux qui hibernent possèdent du tissu adipeux brun. Les cellules de ce tissu sont appelées adipocytes bruns et contiennent des mitochondries particulières qui ne produisent plus d’ATP mais de la chaleur à la place. Des études préliminaires ont permis de mettre en évidence une protéine particulière dans la membrane interne de ces mitochondries. Cette protéine a été appelée thermogénine (aussi nommée UCP pour UnCoupling Protein).
Le but de cette partie est de comprendre les mécanismes moléculaires à l’origine de la modification fonctionnelle du rôle des mitochondries des adipocytes bruns (production de chaleur à la place d’ATP).
Pour cela les expériences suivantes ont été réalisées.
Expérience 5 :
Un agent découplant est une molécule qui perméabilise la membrane interne mitochondriale aux protons. Ainsi un tel agent permet une fuite des protons depuis l’espace intermembranaire vers la matrice mitochondriale, annulant le gradient électrochimique de protons. L’expérience qui suit utilise comme molécule découplante le FCCP. Le potentiel mitochondrial, en mV, est mesuré après ajout de la molécule découplante. Les résultats de l’expérience sont présentés ci-après :
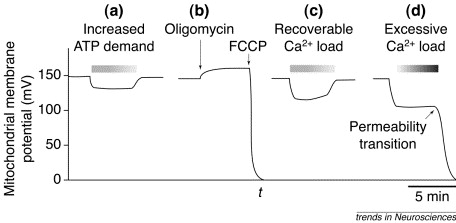
Information utile :
- La protéine initialement caractérisée dans la membrane interne des mitochondries, la thermogénine, provoque des modifications semblables du potentiel mitochondrial.
Expérience 6 :
Les chercheurs ont ensuite souhaité étudier l’effet du FCCP sur le taux de consommation d’oxygène par la mitochondrie (en pico-moles/minute), également appelé oxygen consumption rate en anglais (abrégé OCR). Pour cela il a été mesuré le taux de consommation d’oxygène basal par les cellules (6 premiers cycles de mesures : 1 à 6). Le FCCP a ensuite été injecté dans les cellules et le taux de consommation d’oxygène a été mesuré après injection de FCCP (8 cycles supplémentaires de mesures : 7 à 14). Les résultats de l’expérience sont présentés ci-après :
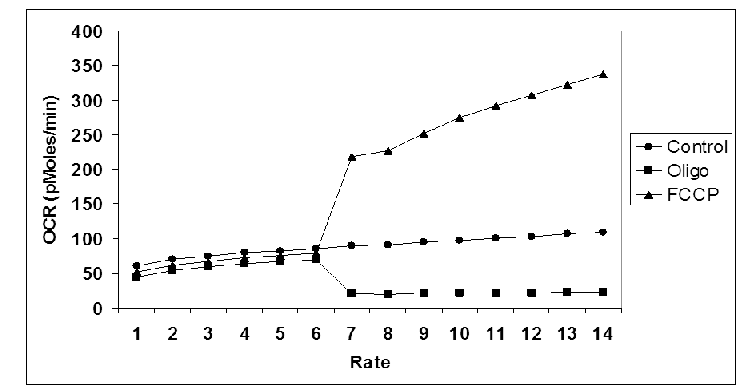
Information utile :
- La protéine initialement caractérisée dans la membrane interne des mitochondries, la thermogénine, provoque des modifications semblables du taux de consommation d’oxygène par les mitochondries.
Question 14 : en se basant sur les expériences 5 et 6, proposer un possible mécanisme à l’origine de la modification fonctionnelle du rôle des mitochondries des adipocytes bruns (production de chaleur à la place d’ATP).
Correction
Question 1 : pour illustrer notre réponse nous allons prendre l’exemple de deux cycles de circulation, c’est-à-dire le passage d’une même portion de sang deux fois de suite au niveau des capillaires pulmonaires.
Lors du premier cycle de circulation : lors de l’apnée les échanges gazeux au niveau de l’interface alvéoles/sang sont interrompus. Partons d’une pression partielle en dioxygène de 100 mmHg dans les capillaires pulmonaires. Au niveau des capillaires systémiques le dioxygène diffuse vers les tissus jusqu’à atteindre une pression partielle en dioxygène de 40 mmHg en sortie des capillaires systémiques. Le sang retourne au niveau des capillaires pulmonaires. Comme les échanges gazeux sont interrompus alors la pression partielle en dioxygène alvéolaire diminue de plus en plus (car le dioxygène diffusant des alvéoles vers le sang n’est pas renouvelé). Si par exemple on part d’une pression partielle en dioxygène alvéolaire de 80 mmHg après 2 minutes d’apnée et que la pression partielle en dioxygène du sang en provenance des artères pulmonaires vaut 40 mmHg alors l’équilibre se fera à 60 mmHg de pression partielle en dioxygène dans les alvéoles et dans le sang en sortie des capillaires pulmonaires. Il en ressort que l’hémoglobine sera moins saturée (environ 90%) et le sang moins enrichi en dioxygène dissout. Dans les capillaires systémiques le dioxygène dissout dans le sang diffusera vers les tissus selon le gradient de pression partielle. Comme la pression partielle de dioxygène a été abaissée à 60 mmHg alors l’équilibre entre les pressions partielles s’installera plus rapidement (équilibre entre 60 mmHg dans le sang et 40 mmHg dans les tissus plus rapide qu’entre 100 mmHg dans le sang et 40 mmHg dans les tissus) et la diffusion s’arrêtera plus rapidement et donc moins de dioxygène sera délivré aux tissus. De plus l’hémoglobine ayant été moins saturée en dioxygène au niveau des capillaires pulmonaires alors les tissus auront moins de dioxygène. Ces deux phénomènes contribuent à abaisser la pression partielle en dioxygène au niveau des tissus, parfois jusque 5 mmHg.
Lors du deuxième cycle de circulation : le sang de retour au niveau des capillaires pulmonaires aura une pression partielle en dioxygène de 40 mmHg (suite à la diffusion du dioxygène des capillaires systémiques vers les tissus lors du premier cycle de circulation, dont la pression partielle en dioxygène tissulaire n’était pas encore abaissée à 5 mmHg mais était encore à 40 mmHg). La pression partielle en dioxygène alvéolaire a encore été plus abaissée au fur et à mesure du temps et elle vaut maintenant 60 mmHg, l’équilibre se fera donc jusqu’à atteindre 50 mmHg de pression partielle en dioxygène dans les alvéoles et dans les capillaires pulmonaires. L’hémoglobine sera encore moins saturée (de l’ordre d’environ 80%). Au niveau des capillaires systémiques les tissus ayant désormais 5 mmHg de pression partielle en dioxygène alors l’équilibre se fera à 5 mmHg pour la pression partielle en dioxygène des capillaires systémiques.
Les différentes valeurs de pressions partielles en dioxygène ont été expliquées.
Question 2 : l’utilisation de chlorure de cobalt mime les effets d’une hypoxie, c’est-à-dire mime la situation rencontrée après 2 minutes d’apnée puisqu’il s’agit d’une situation d’hypoxie, comme indiqué dans l’énoncé. En présence de chlorure de cobalt à la concentration de 100 µM nous observons que la protéine HIF1- est présente dans le cytoplasme des cellules cancéreuses alors qu’elle est absente dans le cytoplasme de ces cellules lorsque le chlorure de cobalt n’a pas été appliqué. Lorsque la concentration de chlorure de cobalt est augmentée à 300 µM la protéine HIF1- est encore plus présente dans le cytoplasme des cellules cancéreuses (car bande plus sombre sur la membrane de western blot). Cela indique deux choses :
- La présence de la protéine HIF1- nécessite une situation d’hypoxie ;
- La protéine est davantage présente quand la concentration de chlorure de cobalt augmente donc sa présence dépend de la dose de chlorure de cobalt appliquée. En cas d’hypoxie plus forte la protéine est davantage présente.
L’expérience a été réalisée sur des cellules cancéreuses mais l’énoncé indique que la protéine HIF1- est présente dans le cytoplasme de toutes les cellules. Il est donc possible de dire que la présence de cette protéine dans les cellules musculaires striées squelettiques nécessite une situation d’hypoxie. Et la quantité de cette protéine est augmentée en cas de plus forte hypoxie.
Au bout de 2 minutes d’apnée (situation d’hypoxie) la protéine HIF1- devient présente dans le cytoplasme des cellules musculaires striées squelettiques alors qu’elle y est absente au repos.
Question 3 : la technique d’immunoblot n’utilise pas l’étape d’électrophorèse et est donc plus rapide et plus simple à mettre en place. Cependant il y a une contrainte à respecter pour utiliser cette technique à la place d’un western blot. L’électrophorèse permet de séparer les différentes protéines d’une cellule selon le poids moléculaire (les plus grosses protéines migreront moins vite vers le bas et seront retrouvées en haut de la membrane, les plus petites protéines seront en bas de la membrane). Cela permet ainsi de séparer dans l’espace deux protéines très proches (en pratique on parle de deux isoformes). Si le chercheur souhaite détecter une protéine, par exemple PDK1, il faut que l’anticorps détectant PDK1 soit très spécifique de PDK1 car il existe en réalité plusieurs isoformes de PDKs. Un anticorps peu spécifique de PDK1 pourrait éventuellement détecter d’autres isoformes de PDKs. Si l’immunoblot a été utilisé avec un tel anticorps alors il détectera différentes isoformes de PDKs au même niveau de la membrane, les bandes seront confondues et le chercheur n’aura aucun moyen de savoir ce qui a été détecté. Alors qu’en western blot les isoformes de PDKs seront séparés dans l’espace et connaissant le poids moléculaire de chaque isoforme de PDK il sera possible de différencier la quantité relative de chaque PDK dans la cellule (en fonction de l’intensité de la bande, plus elle est sombre plus la protéine est présente, voir question 2).
Question 4 : la deuxième expérience montre que la protéine PDK1 est peu présente en normoxie (bandes assez claires) alors qu’elle devient très présente en hypoxie (bandes plus foncées).
Plus l’hypoxie se prolonge plus la protéine PDK1 est retrouvée en grande quantité dans les cellules (les bandes deviennent encore plus sombres après 48h d’hypoxie).
Ce résultat recoupe celui de la première expérience, à savoir qu’en cas d’hypoxie plus forte (c’est-à-dire plus prolongée) la protéine HIF1- était davantage présente.
L’hypoxie est alors corrélée à la présence des protéines HIF1- et PDK1 des cellules musculaires striées squelettiques et ces deux protéines sont en plus grande quantité lorsque la durée d’hypoxie augmente.
Enfin, cette deuxième expérience montre aussi un résultat de confirmation : l’hypoxie mimée par le chlorure de cobalt montre également une augmentation de la quantité de la protéine PDK1.
La donnée issue de la troisième expérience permet d’affirmer que la protéine HIF1- active la protéine PDK1. En absence d’hypoxie il ne devrait pas y avoir activation de PDK1 car pas de présence de HIF1-. Cependant nous avons déjà dit que PDK1 était tout de même présente en petite quantité en normoxie, il est fait l’hypothèse que la cellule exprime toujours une petite quantité de PDK1, même sans hypoxie. Par contre HIF1- nécessite une situation d’hypoxie et en cas d’hypoxie il peut activer PDK1 qui est alors davantage retrouvé en hypoxie.
Comme dit précédemment la protéine HIF1- est davantage présente quand l’hypoxie se prolonge et peut donc davantage activer PDK1, ce qui explique la plus grande présence de la protéine PDK1 lorsque l’hypoxie se prolonge, dans les cellules musculaires striées squelettiques.
La troisième expérience montre alors un lien de causalité entre les protéines HIF1- et PDK1.
Question 5 : la 1ère raison est qu’en situation d’hypoxie la PDK1 est activée or cette enzyme inactive la pyruvate déshydrogénase de la matrice mitochondriale, comme indiqué dans l’énoncé. Pour rappel la pyruvate déshydrogénase facilite la réaction enzymatique suivante :
L’inactivation de la pyruvate déshydrogénase conduit donc à l’arrêt de synthèse d’acétyl-coA. Or l’acétyl-coA est nécessaire pour la première réaction du cycle de Krebs en se combinant avec l’oxaloacétate pour donner la citrate grâce à la première enzyme du cycle : la citrate synthase.
Le cycle de Krebs s’arrête, le pouvoir réducteur n’est plus généré, la chaine de transport des électrons de la membrane interne mitochondriale s’arrête, les protons ne sont donc plus repompés de la matrice mitochondriale vers l’espace intermembranaire et s’accumulent dans la matrice, ce qui annule le gradient électrochimique de protons.
Or pour que le pyruvate puisse passer la membrane interne mitochondriale (très imperméable) il utilise un symport protons/pyruvate aussi appelé pyruvate translocase, permettant le transport du pyruvate et des protons vers la matrice. Ce transport est un transport actif secondaire de sorte qu’il utilise l’énergie contenue dans le gradient électrochimique des protons. Si le gradient électrochimique de protons est annulé alors ce transport ne se fait plus.
La 2ème raison est que l’inhibition de l’enzyme pyruvate déshydrogénase conduit à une accumulation du pyruvate dans la matrice mitochondriale (car n’est plus transformé en acétyl-coA). Si le pyruvate ne s’accumulait pas dans la matrice et était consommé il pourrait alors y avoir transport du pyruvate depuis le cytoplasme vers la matrice mitochondriale, même si le gradient électrochimique de protons est annulé car dans ce cas le gradient de concentration du pyruvate serait en faveur de son entrée vers la matrice (plus concentré dans le cytoplasme que dans la matrice).
Donc en situation d’hypoxie le pyruvate ne peut plus aller dans les mitochondries pour être transformé dans le cycle de Krebs et fournir de l’ATP aux cellules. Pourtant les cellules ont besoin d’ATP, même en hypoxie.
Question 6 : en hypoxie les résultats de l’expérience montrent une plus grande libération de lactate déshydrogénase (LDH) par les cellules. Il est fait deux hypothèses :
- Cette plus grande libération doit refléter en réalité une plus grande quantité de LDH dans le cytoplasme de ces cellules en hypoxie ;
- Les cellules en hypoxie et en normoxie contiennent la même quantité de LDH dans leur cytoplasme mais l’hypoxie stimule une plus grande libération de LDH.
La première hypothèse permet de dire qu’en hypoxie la cellule produit davantage de LDH. Selon la réaction donnée dans l’énoncé le pyruvate cytoplasmique sera alors pris en charge davantage par cette enzyme pour donner du lactate et du NAD+. Ce qu’il faut remarquer c’est qu’il s’agit d’une réaction d’oxydo-réduction, le pyruvate est réduit en lactate et le NADH est réoxydé en NAD+. Cela permet de mettre à disposition du NAD+ renouvelé et qui pourra servir à continuer la glycolyse car la réaction catalysée par l’enzyme glycéraldéhyde-3-phosphate déshydrogénase de la glycolyse nécessite du NAD+ qui est réduit en NADH pour oxyder le glycéraldéhyde-3-phosphate en 1,3-bisphosphoglycérate (phosphorylation oxydative avec un phosphate inorganique servant à créer le deuxième groupement phosphate en première position de la molécule). Cette réaction permise par la LDH cytoplasmique est appelée fermentation lactique et a lieu en hypoxie. Elle permet de réoxyder le NADH cytoplasmique en NAD+ cytoplasmique, la glycolyse peut alors se poursuivre pour produire 2 molécules d’ATP comme rendement final. En hypoxie peu d’ATP est donc produit par rapport à la normoxie mais cet ATP est produit plus rapidement (pas d’étapes de cycle de Krebs et chaine respiratoire mitochondrial). En normoxie ce sont les systèmes de navettes (glycérol-3-phosphate et malate-aspartate) qui permettent de réoxyder le NADH cytoplasmique puisque la fermentation lactique n’a pas lieu.
Comme le pyruvate cytoplasmique est pris en charge par la LDH, il ne s’accumule jamais suffisamment dans le cytoplasme pour que le gradient de concentration soit favorable à son entrée dans la mitochondrie (malgré l’accumulation de pyruvate mitochondrial), cela empêche donc également l’entrée de pyruvate dans la matrice, cette entrée ne serait physiologiquement pas pertinente puisqu’en hypoxie le pyruvate ne serait pas transformé en acétyl-coA (voir réponses précédentes).
La deuxième hypothèse ne permet pas de dire qu’en hypoxie la cellule produit davantage de LDH. Il pourrait y avoir davantage de mort cellulaire en hypoxie, donc les cellules éclatent davantage et laissent fuiter leur contenu cytoplasmique dans le milieu extracellulaire, d’où une plus grande libération de LDH sans pour autant que les cellules en produisent plus en hypoxie. Cette seule hypothèse est très peu probable puisque la production d’ATP en hypoxie se fait uniquement via la fermentation lactique et produit déjà beaucoup moins d’ATP qu’en normoxie. Il est alors raisonnable de penser que la cellule augmente bien sa production de LDH en hypoxie pour augmenter la production d’ATP via la fermentation lactique.
En vérité une combinaison des deux hypothèses est ce qui doit se rapprocher le plus de la réalité. En hypoxie les cellules produisent plus de LDH et il y a également plus de mort cellulaire, faisant éclater les cellules et donc le milieu extracellulaire contient plus de LDH en hypoxie (% de libération du LDH plus élevé en hypoxie qu’en normoxie).
Question 7 : au bout de 2 minutes d’apnée l’oxymyoglobine sera suffisamment désaturée pour libérer assez d’oxygène dans les cellules musculaires striées squelettiques d’après l’énoncé. Cependant au bout de 2 minutes d’apnée la cellule est dans une situation d’hypoxie et grâce aux réponses précédentes nous voyons que seule la fermentation lactique est utilisée pour produire de l’ATP. Or la fermentation n’a pas besoin de dioxygène, c’est la chaine respiratoire mitochondriale qui en a besoin en normoxie où le dioxygène joue le rôle d’accepteur final des électrons (réduction du dioxygène en eau). Ainsi le dioxygène, bien que libéré par la myoglobine au bout de 2 minutes d’apnée, pourrait ne pas être consommé par la cellule musculaire.
Néanmoins ce dioxygène pourra servir lorsque la cellule sera revenue en condition de normoxie car la personne va bien devoir respirer un jour. 
Question 8 : (1) la forme hyperbolique est due au fait que la myoglobine n’est pas une protéine allostérique car elle n’a qu’un seul site de liaison du dioxygène contrairement à l’hémoglobine qui en possède quatre. Ainsi il n’y a pas de coopérativité positive de sorte que la liaison d’une molécule de dioxygène facilite la liaison de la prochaine molécule de dioxygène sur un autre site de la même molécule de myoglobine puisque la myoglobine ne comporte qu’un seul site de fixation du dioxygène !
(2) Pour une pression partielle en dioxygène donnée la saturation de la myoglobine est supérieure à celle de l’hémoglobine car la myoglobine a une affinité supérieure pour le dioxygène par rapport à l’hémoglobine. Par exemple à 40 mmHg (pression partielle en dioxygène des capillaires systémiques) la saturation de l’hémoglobine est d’environ 70%. Mais pour cette même pression partielle en dioxygène, qui est aussi rencontrée dans les tissus donc dans les muscles, la saturation de la myoglobine sera proche de 100%. Concrètement cela signifie qu’une même quantité de dioxygène dans l’environnement proche de la myoglobine (par rapport à celle retrouvée dans l’environnement proche de l’hémoglobine) est suffisante pour occuper plus de molécules de myoglobine. Il faudra que la pression partielle en dioxygène dans le muscle soit davantage abaissée pour que la quantité de dioxygène ne suffise plus pour occuper toutes les molécules de myoglobine : à ce moment-là la myoglobine aura donc libéré du dioxygène dans la cellule musculaire.
Cela est donc utile physiologiquement puisque 40 mmHg est la pression partielle en dioxygène rencontrée en normoxie dans les cellules musculaires. La myoglobine n’a pas besoin de libérer du dioxygène car la cellule en dispose assez : elle est saturée à près de 100%. Lors d’un effort plus intense la pression partielle en dioxygène dans le muscle diminue et il devient pertinent physiologiquement de libérer du dioxygène depuis la myoglobine. Lors de l’apnée la pression partielle en dioxygène dans le muscle diminue encore davantage et le métabolisme prépondérant est la fermentation lactique. La myoglobine va libérer du dioxygène qui ne sera pas utilisé tout de suite (la fermentation n’utilise pas de dioxygène) mais uniquement lorsque la chaine respiratoire mitochondriale sera de nouveau utilisée (voir réponse à la question 7).
Question 9 : les deux populations de cellules (cancéreuses et non cancéreuses) sont placées en condition de normoxie, pourtant les cellules cancéreuses ont davantage de protéines HIF1- et cela indique donc que dans ce cas ce n’est pas l’hypoxie qui est à l’origine de cette surproduction de protéines HIF1- mais que c’est le statut cancéreux des cellules qui en est à l’origine.
Les réponses aux questions précédentes suggèrent qu’une plus grande quantité de la protéine HIF1- est associée à une plus grande activation de la protéine PDK1, elle-même inactivant la pyruvate déshydrogénase avec tous les effets déjà décrits précédemment, c’est-à-dire un arrêt de la chaine respiratoire mitochondriale avec à la place la fermentation lactique pour produire l’ATP dont la cellule a besoin.
On en déduit donc que même en normoxie les cellules cancéreuses utiliseront la fermentation lactique pour produire l’ATP : c’est ce qui est appelé l’effet Warburg. Comme le rendement en ATP durant la fermentation est beaucoup moins important qu’avec la chaine respiratoire mitochondriale (voir précédemment) alors ces cellules cancéreuses seront forcées de consommer une plus grande quantité de glucose pour produire une quantité équivalente d’ATP par rapport à celle qui serait obtenue avec la chaine respiratoire mitochondriale. Cela diminue donc la biodisponibilité du glucose pour les cellules saines autour de la tumeur et participe à l’affaiblissement de l’organisme.
Question 10 : l’effort intense nécessite des contractions musculaires intenses. Ces contractions nécessitent de l’ATP (voir première partie du cours). Ainsi lors des premières secondes d’un effort intense le taux d’ATP dans la cellule musculaire diminuera grandement, en fait c’est le rapport qui diminuera. La réaction catalysée par la créatine kinase se fera donc en faveur de la formation d’ATP pour renouveler son stock, c’est-à-dire de gauche vers la droite. Au contraire lorsque la cellule dispose d’ATP en quantité suffisante, typiquement dans un muscle au repos, le rapport est élevé et la réaction se fait en faveur de la formation d’ADP pour former de la créatine-phosphate qui pourra être utilisé lorsque la cellule manquera d’ATP (réaction inverse puisque la réaction est réversible et peut donc se faire dans les deux sens).
Question 11 : lors des premières secondes d’un effort intense le taux d’ATP diminue. Comme l’ATP est un effecteur hétérotrope négatif de cette enzyme (la phosphofructokinase) alors moins d’ATP signifiera moins d’inhibition allostérique de cette enzyme, l’enzyme aura plus d’affinité pour son substrat (le fructose-6-phosphate) et la réaction pourra davantage avoir lieu. Donc davantage de molécules de fructose-6-phosphate seront consommées pour former des molécules de fructose-1,6-bisphosphate par unité de temps : la vitesse de la glycolyse sera accélérée.
Question 12 : si la vitesse de la glycolyse est accélérée alors plus de pyruvate sera formé par unité de temps. Plus de pyruvate ira dans la mitochondrie pour donner de l’acétyl-coA grâce à l’enzyme pyruvate déshydrogénase. Le cycle de Krebs sera plus sollicité et finalement la chaine respiratoire mitochondriale également. Par unité de temps il y aura donc davantage de consommation de dioxygène par les mitochondries. Cela va abaisser la pression partielle en dioxygène dans la cellule car le dioxygène sera beaucoup plus consommé. Parallèlement plus de dioxyde de carbone sera donc produit par la cellule et le dioxygène deviendra un gaz sous-représenté dans la cellule, il exercera une moindre pression partielle. Finalement la pression partielle en dioxygène des capillaires systémiques irriguant ces cellules musculaires sera également abaissée car il y aura diffusion du dioxygène depuis ces capillaires jusqu’aux cellules musculaires et cela jusqu’à équilibre des pressions partielles en dioxygène.
Question 13 : il y a donc moins de dioxygène dans les cellules durant les premières secondes d’un effort intense et une situation d’hypoxie s’installe. Selon la réponse à la question 6 la cellule musculaire utilisera la fermentation lactique pour produire temporairement l’ATP dont elle a besoin.
Lors des débuts d’un effort intense il y a donc successivement :
- Contractions musculaires intenses et soutenues : baisse drastique du taux d’ATP intracellulaire ;
- La réaction catalysée par la créatine kinase est favorisée en faveur de la formation d’ATP, pour tenter de rétablir les stocks d’ATP en baisse (métabolisme anaérobie alactique) ;
- Réaugmentation transitoire du taux d’ATP car l’ATP produit est directement consommé par le muscle ;
- Les stocks de créatine-phosphate s’épuisent et donc l’ATP est plus rapidement consommé qu’il n’est produit : la production d’ATP via la chaine respiratoire mitochondriale est longue, il y a plusieurs étapes (glycolyse, cycle de Krebs, chaine respiratoire mitochondriale) alors que l’ATP fourni par la créatine-phosphate est plus rapide ;
- Le taux d’ATP intracellulaire chute ;
- Levée de l’inhibition allostérique de la phosphofructokinase, la vitesse de la glycolyse s’en trouve accélérée ;
- Consommation de dioxygène accrue au niveau de la chaine respiratoire mitochondriale et production parallèle accrue de dioxyde de carbone par le cycle de Krebs ;
- Baisse de la pression partielle en dioxygène dans la cellule et augmentation de la pression partielle en dioxyde de carbone dans la cellule : situation d’hypoxie ;
- Mise en place de la fermentation lactique pour produire l’ATP dont la cellule a besoin de manière plus rapide (une seule étape : la glycolyse) même si le rendement s’en trouve grandement diminué ;
- Diminution de la pression partielle en dioxygène dans les capillaires irriguant ces muscles ;
- Augmentation de la pression partielle en dioxyde de carbone dans les capillaires irriguant ces muscles ;
- Diminution de la saturation de l’hémoglobine au niveau des capillaires irriguant ces muscles ;
- L’organisme réagit à une pression partielle en dioxyde de carbone artériel élevée ainsi qu’à une faible pression partielle en dioxygène artériel ;
- Hyperventilation qui provoque une augmentation de la pression partielle en dioxygène alvéolaire et une diminution de la pression partielle en dioxyde de carbone alvéolaire ;
- Augmentation de la pression partielle en dioxygène artériel et diminution de la pression partielle en dioxyde de carbone artériel : augmentation de la saturation de l’hémoglobine au niveau des capillaires pulmonaires (100% de saturation) ;
- Au niveau des capillaires systémiques irriguant ces muscles cela permet de libérer davantage de dioxygène à ces cellules musculaires afin de rétablir la pression partielle en dioxygène dans les muscles et rétablir le métabolisme aérobie (cycle de Krebs et chaine respiratoire mitochondriale). Cela fournira l’ATP nécessaire à ces cellules pour un plus long effort.
Question 14 : l’expérience 5 montre que l’addition du découplant FCCP annule le potentiel mitochondrial. Cela s’explique parce qu’un découplant perméabilise la membrane interne mitochondriale aux protons en formant des pores permettant le passage des protons. Les protons fuitent donc depuis l’espace intermembranaire vers la matrice mitochondriale. Cela égalise les concentrations en protons de part et d’autre de la membrane interne mitochondriale et donc le potentiel membranaire s’annule.
Or la production d’ATP nécessite ce gradient électrochimique de protons, l’ATP n’est donc plus produit en présence d’un découplant comme le FCCP.
Selon l’énoncé la thermogénine annule également le potentiel mitochondrial. Il est très probable que la thermogénine annule ce potentiel en annulant le gradient électrochimique des protons. Finalement la thermogénine empêcherait la production d’ATP par les mitochondries des adipocytes bruns.
Il reste à expliquer la production de chaleur par ces mitochondries.
L’expérience 6 montre que l’addition de FCCP augmente la consommation de dioxygène par les mitochondries de cellules. Cela s’explique parce que la chaine respiratoire mitochondriale tend à rétablir le gradient électrochimique des protons quand le FCCP est présent. Pour cela il est nécessaire d’accélérer le flux des électrons dans la chaine respiratoire (et donc la consommation de dioxygène comme accepteur final d’électrons). Ainsi le pompage des protons depuis la matrice vers l’espace intermembranaire sera accéléré afin d’avoir plus de protons dans l’espace intermembranaire par rapport à la matrice. Le gradient électrochimique des protons sera faiblement rétabli mais assez pour avoir une fuite des protons depuis l’espace intermembranaire vers la matrice, à travers les pores de la membrane interne générés par le FCCP. Cette fuite de protons ne se fera donc pas via l’ATP synthase (qui permet la formation d’ATP) mais via les pores formés par le FCCP. Cette fuite ne permet donc pas la synthèse d’ATP mais plutôt la production de chaleur. On dit qu’il y a découplage car l’agent découplant découple (sépare) la chaine de transport d’électrons de la production d’ATP, à la place il y a production de chaleur. Le gradient électrochimique des protons, préalablement rétabli, va ensuite rapidement s’annuler lors de cette fuite des protons. À nouveau la chaine respiratoire mitochondriale va tenter de rétablir le gradient électrochimique des protons en consommant davantage de dioxygène, il y aura donc rétablissement temporaire de ce gradient, fuite des protons vers la matrice puis libération de chaleur lors de cette fuite. Ce cycle va se répéter indéfiniment. Il est à noter que la "première fuite de protons", c’est-à-dire lors de l’annulation du potentiel mitochondrial par l’agent découplant, est responsable de la plus grande production de chaleur par la mitochondrie.
Selon l’énoncé la thermogénine augmente aussi la consommation d’oxygène par les mitochondries. Il est très probable que la thermogénine augmente cette consommation d’oxygène afin d’accélérer le flux des électrons dans le but de rétablir le gradient électrochimique de protons. La thermogénine va donc permettre la production de chaleur lors de la fuite des protons depuis l’espace intermembranaire vers la matrice.
Avec ces deux expériences et le comportement analogue de la thermogénine et du FCCP, il devient raisonnable de penser que la thermogénine est une protéine découplante naturellement retrouvée dans la membrane interne des mitochondries des adipocytes bruns. Elle permet la production de chaleur à la place de celle d’ATP.