Bonjour à tous,
J’ai ce graphe ci-dessous:
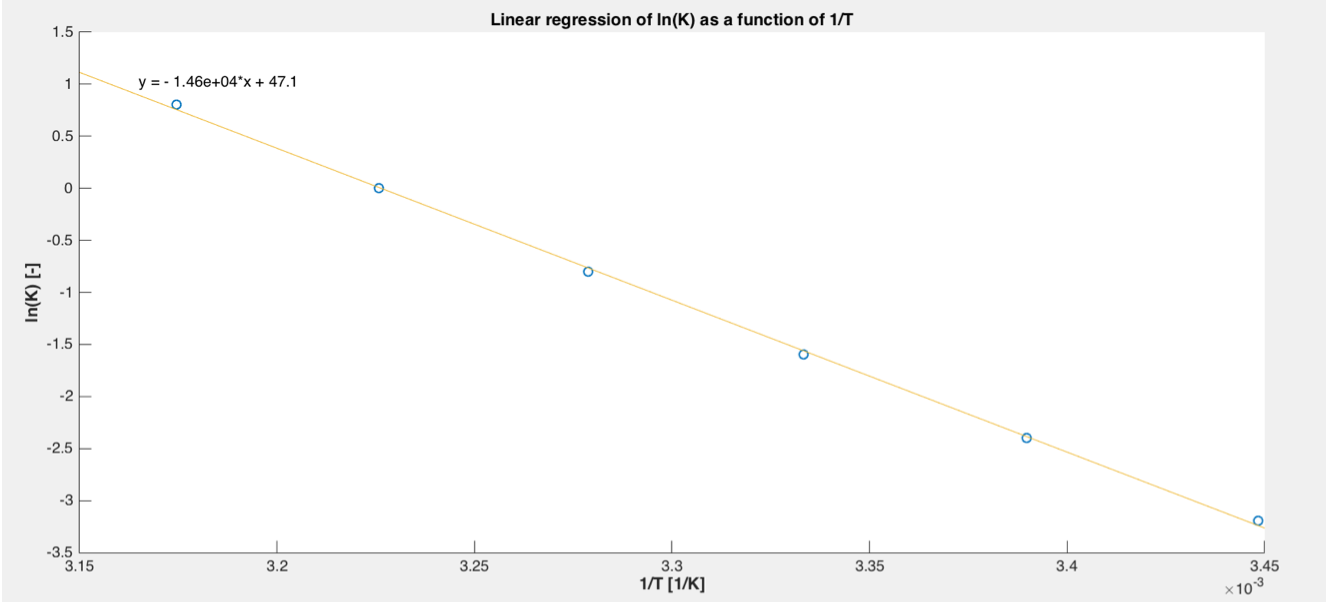
De plus je connais la relation $\ln K = - \frac{{\Delta H}}{{RT}} + \frac{{\Delta S}}{R}$. On me demande les valeurs de l’enthalpie et de l’entropie à 298K. Du coup, j’ai fais $\Delta S = 47.1*R = 391.6J/(mol*K)$ (cf. graphe pour l’équation de la droite). Pour l’enthalpie: $ - \frac{{\Delta H}}{R} = - 1.46*{10^4}*\frac{1}{{298}} \to \Delta H = 407.33J/mol$.
Est-ce correct ? Les résultats me semblent bizarre car les enthalpies sont souvent exprimées en kJ/mol…
Merci d’avance 
+0
-0
 (et du coup, ça fait un peu plus, voire même beaucoup, mais je sais pas de quoi on parle)
(et du coup, ça fait un peu plus, voire même beaucoup, mais je sais pas de quoi on parle)