Bonjour,
On me demande de dire combien d’éthanol et d’eau devraient être mélangés pour avoir un mélange de 100 mL à 50% en masse d’éthanol et 50% en masse d’eau sachant que ${\rho _E} = 0.789$ $g/mL$ et ${\rho _W} = 0.997$ $g/mL$ (W = eau, E = ethanol). Je dois utiliser le graphique donné:
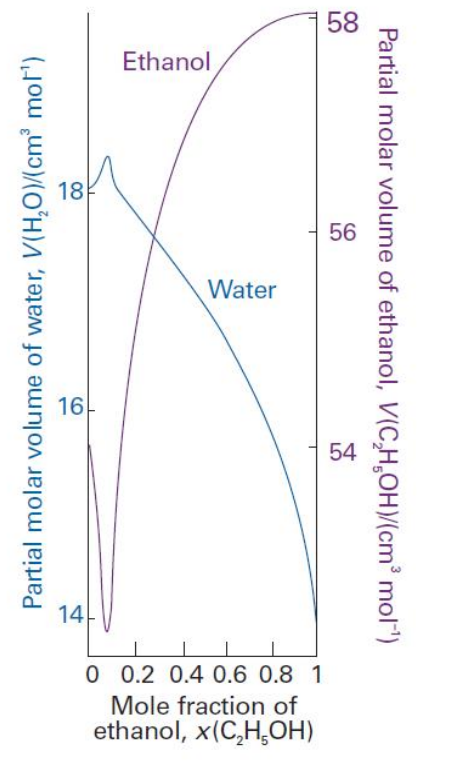
Ce que j’ai fais:
$m(E) = m(W)$ donc $n(W)M(W) = n(E)M(E)$ -> $x(E) = \frac{{n(E)}}{{n(E) + n(W)}} = \frac{{\frac{{n(W)M(W)}}{{M(E)}}}}{{n(W)\frac{{M(W)}}{{M(E)}} + n(W)}} = \frac{{M(W)}}{{M(W) + M(E)}} = 0.72$
Ici le corrigé trouve $x(E) = 0.28$ donc ce que moi je trouve pour $x(W)$ et je vois pas pourquoi. Puis, je cherche dans le graphique les volumes molaires. Après, je vois pas comment faire pour avoir le volume de chaque. Je sais que je peux utiliser $V = n(E) V_{m,E} + n(W) V_{m,W}$ mais je vois pas comment faire rentrer les fractions molaires.