Bonjour à tous,
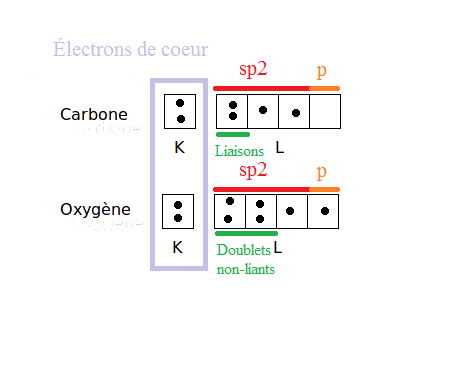
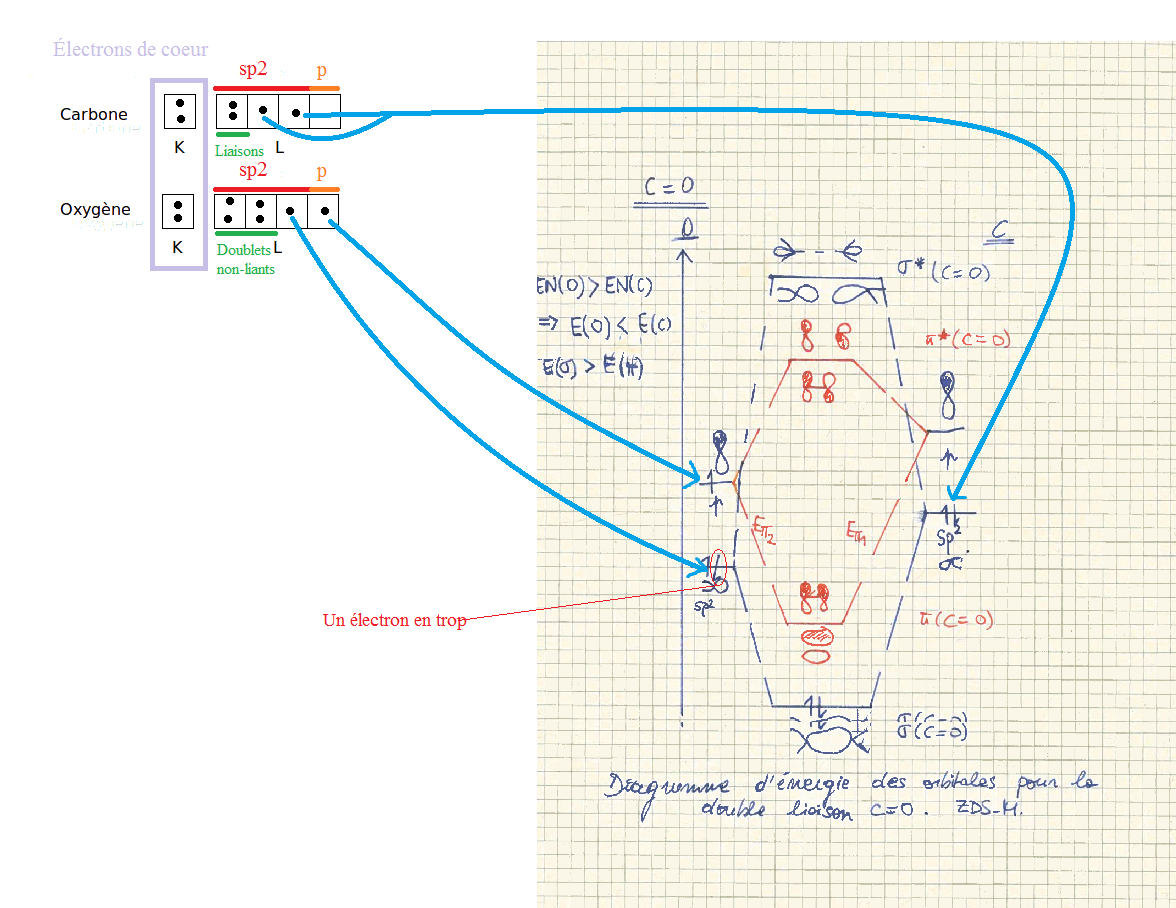
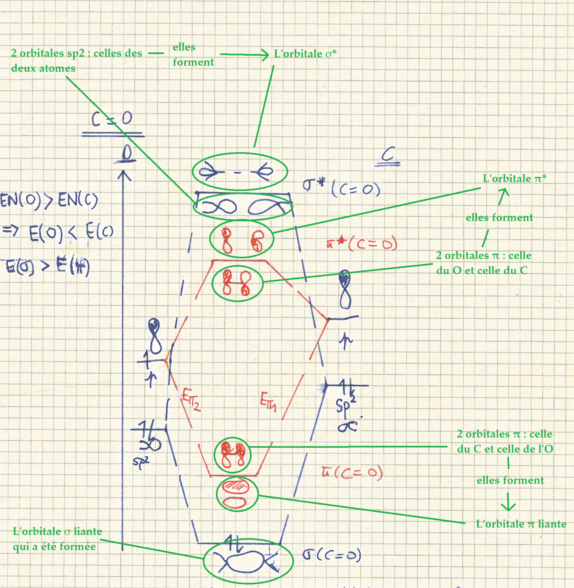
J'ai des questions par rapport aux orbitales. J'ai pas super bien capté les diagrammes d'énergies pour les liaisons. J'ai eu dans mon cours celui de la liaison C=O (voir ici: http://cl.ly/2c2x3l0O3I3c ). Tout d'abord: je ne comprends pas cette manière de représenter les orbitales: ces espèces de "queues", j'ai jamais vu… Auriez-vous un document qui résume ce genre de notations ? Après je vous propose de dire ce que je pense avoir compris et si c'est faux vous m'arrêtez: - comme dans une liaison C=O le carbone est hybridé sp2 , c'est pour cela qu'on a cette orbitale ; de même pour l'oxygène. Ces deux orbitales vont s'allier pour former l'orbitale sigma de la double liaison C=O. - étant donné qu'on a une double liaison, on a aussi deux orbitales pi formées à partir des 2 orbitales p.
Ce que je ne comprends clairement pas: - comment on sait comment d'électrons mettre dans les orbitales des C et O ? Je pensais que c'était par rapport à leur structure électronique mais sinon il y en aurait beaucoup plus. Je pensais aussi qu'on devait avoir de px, py et pz mais visiblement elles ne sont pas marquées (pourquoi?). - Que représentent les énergies ${E_{{\pi _1}}}$ et ${E_{{\pi _2}}}$ ? Pourquoi on a pas fait pareil pour la sigma ? - Dernière chose, quelle est l'orbitale tout au dessus ? (juste au dessus la sigma anti-liante de C=O).
Désolé si mes questions peuvent paraître très stupides mais j'aimerais bien comprendre les choses 
Merci d'avance!

 .
.
 ), on obtient :
), on obtient :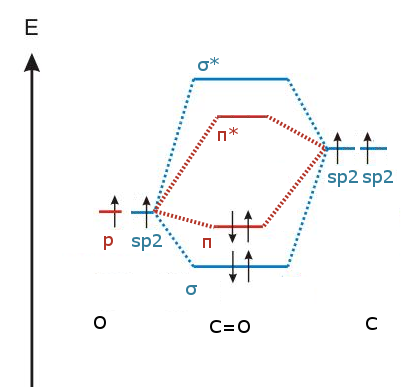
 Puisque tu as évoqué l'ordre de liaison; je pensais que tant qu'il n'était pas nul (même s'il n'est pas entier) la liaison (molécule) pourrait exister. C'est faux donc ? L'ordre de liaison doit absolument être entier?
Puisque tu as évoqué l'ordre de liaison; je pensais que tant qu'il n'était pas nul (même s'il n'est pas entier) la liaison (molécule) pourrait exister. C'est faux donc ? L'ordre de liaison doit absolument être entier?